 |
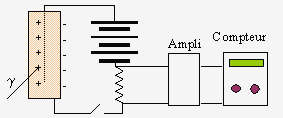 |
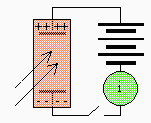
| Chambre d'ionisation. | Compteur Geiger. |
RADIOACTIVITÉ NATURELLE
|
Le chapitre précédent a porté sur les isotopes stables. Il existe aussi des isotopes instables, radioactifs. Questions :
Objectifs :
|
De nombreux livres traitent de la découverte de la radioactivité naturelle par H. BECQUEREL (1896) ainsi que la séparation du premier radioélément connu, le radium par Pierre et Marie CURIE en 1898. Le radium se distingue seulement par son intense activité. Il existe bien entendu d'autres éléments qui ne furent découvert que plus tard.
On s'est rapidement aperçu que les substances radioactives émettent des particules (rayons a et b) et des ondes électromagnétiques (rayons g). Les instruments développés pour étudier ces diverse émissions sont également dans divers ouvrages. Mentionnons :
- l'électroscope, - la chambre d'ionisation,
- le compteur GEIGER-MÜLLER, - le compteur à scintillations,
- le détecteur CÉRENKOV, - la chambre à bulles,
- la chambre à détente de WILSON,...
Il n'est pas nécessaire ici de revoir les propriétés de chacun de ces instruments. La chambre d'ionisation est mieux adaptée à la détection de particule; le compteur GEIGER et le compteur à scintillations sont utilisés avec les rayonnements g. La figure 15.1 résume leurs propriétés et modes de fonctionnement. Ajoutons que les chambres de WILSON et à bulles permettent de visualiser les trajectoires des particules. Il est plus pertinent de revoir en détail les propriétés associées à chacune de ces émissions. Tous les rayonnements nucléaires sont émis avec des énergies énormes atteignant les quelques millions d'électronvolts (MeV).
2. Le rayonnement a
Ce sont des particules chargées positivement. Si on accumule les particules a émises par une substance radioactive dans un tube de verre, on obtient dans le tube de l'hélium gazeux. Les mesures de masse et de charge par la méthode de la déviation électrique et magnétique confirme leur identité avec le noyau de l'atome d'hélium. La transformation en hélium se fait après capture de deux électrons (toujours présents partout) une fois la particule ralentie.
 |
 |
| Chambre d'ionisation. | Compteur Geiger. |
 |
 |
| Compteur à scintillations | Réponse comparée des divers détecteurs. |
Figures 15.1. Détecteurs et compteurs de particules.
La loi de conservation de la masse exige que la transmutation se fasse selon la loi suivante :
Exemple : |
 |
1ère loi de SODDY:
| Un élément radioactif qui se désintègre avec émission de rayons a engendre un élément qui a rétrogradé de deux places dans la classification périodique. Sa masse atomique est inférieure de quatre unités à celle de l'élément générateur. |
Ces particules sont absorbées par de très minces couches de matière. La chambre de WILSON permet d'observer la pénétration des particules a dans l'air. On constate que les rayons a émis par un élément ont tous un parcours identique dans l'air (3,39 cm pour le radium). Il est donc relativement facile de distinguer les rayons a provenant de chaque constituant d'un mélange de radioéléments.
La longueur du parcours dans l'air diffère pour chacun d'eux. La constance de ce parcours dans l'air montre que les rayons a sont émis avec une énergie bien déterminée pour un élément donné (Fig. 15.2).
|
|
Figure 15.2. Radioactivité a (émission a).
Exemples :
| Émetteur | U | Bi | At |
| Énergie (MeV) | 4,19 | 6,05 et 6,09 | 8,0 |
La plupart des rayons a émis par des substances naturelles ont des énergies dans l'intervalle de 3 à 8 MeV, ce qui correspond à des parcours de quelque 3 à 8 cm dans l'air. La mesure de ce parcours dans l'air est une bonne mesure de l'énergie des particules a . Les parcours dans les matières solides sont très faibles de sorte que tous ces rayons sont pratiquement absorbés par les parois des récipients qui contiennent les produits radioactifs.
Théorie de l'émission a
L'uranium-238 émet naturellement un rayonnement a avec une production de thorium :
T1/2 = 1,42 1017 s :
![]()
Considérons le diagramme d'énergie du thorium. Il a été établi que des rayons a ayant une énergie cinétique inférieure à 8,8 MeV, sont incapables de traverser la barrière coulombienne située autour du noyau (Fig. 15.3).
|
|
Figure 15.3. Effet tunnel.
Le noyau d'uranium-238 correspond à un noyau de thorium-234 auquel on viendrait ajouter un noyau a avec une énergie de 4,19 MeV. C'est trop peu d'énergie pour passer la barrière de potentiel. Classiquement, il ne peut y avoir émission d'a ainsi piégé.
En mécanique ondulatoire, GAMOV (1928) et GURNEY et CONDON, indépendamment, ont proposé l'effet tunnel. La probabilité de l'émission dépend de la hauteur et de la largeur de la barrière de potentiel (Fig. 15.3).
3. Le rayonnement b
La loi de conservation de la masse exige que la transmutation se réalise selon la loi suivante (Fig. 15.5):
| Exemple : Fig. 15.4 |
 |
|
|
Figures 15.4 et 15.5. Comparaison entre les radioactivités b- et b+.
2e loi de SODDY :
| Un élément radioactif qui se désintègre avec émission de rayons b- engendre un élément qui a avancé d'une place dans la classification périodique. Sa masse atomique est égale à celle de l'élément générateur. |
Ce sont des particules chargées négativement et de
masse égale à celle de l'électron. Un antineutrino, ![]() , doit être
ajouté aux produits
de réaction pour satisfaire aux règles de conservation. Les deux réactions
précédentes sont équivalentes à la transformation, au sein du noyau, d'un neutron en
un proton et un électron. Les expériences de déflexion électrique et magnétique
confirment cette identification. Ils montrent aussi, que pour un élément donné, ces
électrons ne sont pas tous émis avec la même énergie cinétique. L'étude au
spectrographe montre que la distribution des vitesses des électrons émis par un
élément est relativement large. Il existe une vitesse maximum qui ne peut donc être
dépassée : ce maximum est caractéristique de l'élément émetteur.
, doit être
ajouté aux produits
de réaction pour satisfaire aux règles de conservation. Les deux réactions
précédentes sont équivalentes à la transformation, au sein du noyau, d'un neutron en
un proton et un électron. Les expériences de déflexion électrique et magnétique
confirment cette identification. Ils montrent aussi, que pour un élément donné, ces
électrons ne sont pas tous émis avec la même énergie cinétique. L'étude au
spectrographe montre que la distribution des vitesses des électrons émis par un
élément est relativement large. Il existe une vitesse maximum qui ne peut donc être
dépassée : ce maximum est caractéristique de l'élément émetteur.
|
|
Figure 15.6. Structures nucléaires de trois isobares.
Mais il existe aussi une émission d'un rayonnement constitué d'électrons chargés positivement : ce sont des positons.
| Exemple : |
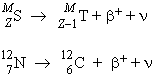 |
Le symbole grec n "nu" représente un neutrino. Il faut noter que les trois éléments que sont le carbone, l'azote et le bore-12 sont des isobares : ils ont la même masse M. On peut décrire chacun des trois noyaux par des paires de protons et de neutrons (Fig. 15.4 à 15.6). On peut voir d'après la figure 15.6 que le noyau de bore-12 a un neutron qui gagne à venir occuper un niveau énergétique libre du côté des protons et inversement dans le cas de l'azote-12. Avec autant de neutrons que de protons qui occupent tous les niveaux d'énergie inférieurs, le carbone-12 est l'élément stable.
Le pouvoir de pénétration des rayons b bien que limité à de faibles épaisseurs de matière est cependant beaucoup plus grand que celui des rayons a. Ce pouvoir de pénétration dépend bien entendu de la valeur de l'énergie maximum des b. Il faut plusieurs millimètres d'aluminium pour arrêter ces particules, en tout cas ceux provenant des émetteurs les plus communs. La mesure de l'épaisseur d'arrêt, c'est-à-dire l'épaisseur d'aluminium qui arrête complètement tous les b, est une bonne détermination de la valeur maximum de leur énergie et peut donc servir à caractériser l'émetteur. Ce pouvoir de pénétration plus grand du rayonnement b par rapport au rayonnement a est du à leur charge et surtout à leur masse beaucoup plus faible.
Il existe aussi une forme inverse d'émission b plus précisément appelée la capture électronique : C. E. Dans ce cas, un électron orbital se combine à un proton pour former un neutron. Bien que ce soit un rayonnement analogue à l'émission b on ne mesure pas de particule. Mais puisqu'une orbitale K est devenue vacante, il y a alors émission de rayonnement X; à partir de l'élément nouvellement formé :
| Exemple : |
 |
4. Le rayonnement g
La loi de conservation de la masse se traduit par :
![]()
et la loi de conservation de la quantité de mouvement exige que l'atome S soit propulsé avec une vitesse de recul au moment de l'expulsion du photon g. En effet,
h n / c = m u .
Les rayons g sont de même nature que les rayons X. Ces radiations électromagnétiques ont une fréquence encore plus grande et sont beaucoup plus pénétrants. La mesure de fréquence de ce rayonnement pose un problème expérimental. La diffraction par les cristaux permet seulement de mesurer les rayons g de courte longueur d'onde. On ne peut observer la diffraction pour les rayons de courte longueur d'onde, car celle-ci devient trop petite par rapport à la dimension de la maille cristalline. On peut alors utiliser l'effet photoélectrique par ces g (sur l'étain, par exemple) et mesurer l'énergie maximum des photoélectrons produits avec un spectrographe b. L'effet COMPTON (voir Chapitre 4.8) observé à la chambre de WILSON peut aussi être utilisé. Les diverses mesures de fréquences s'accordent à montrer que les rayons g émis par un élément le sont avec une fréquence bien déterminée caractéristique de l'élément. Il s'agit donc d'une émission discrète analogue à l'émission d'une raie visible. Un même élément peut émettre plusieurs fréquences g, fréquemment associées avec l'émission de particules a ou b.
Le grand pouvoir de pénétration des rayons g les rend très dangereux. Ils sont capables de traverser plusieurs dizaines de centimètres de plomb, et ceci d'autant plus que leur énergie hn est grande.
5. Interaction des rayonnements nucléaires avec la matière
Deux facteurs importants contribuent à la diminution de l'intensité d'une radiation: la loi de l'inverse carré de la distance et la probabilité d'absorption par la matière. Le premier est un facteur géométrique et n'est pas en relation avec l'absorption de la radiation. Le second dépend du type et de l'énergie de la radiation et du type de matériau absorbant.
a- Rayons a et b
Toutes les radiations transportant des particules chargées perdent leur énergie par interaction avec la matière essentiellement de la même façon. Cette interaction se fait essentiellement entre les particules et les électrons du matériau absorbant. Les forces d'attraction ou de répulsion coulombienne sont suffisamment grandes soit pour exciter un électron à l'intérieur de l'atome, soit pour arracher un électron de l'atome. Si l'électron est enlevé, l'électron négatif et l'ion positif résultant sont appelés une paire d'ions . Chaque radiation perd son énergie par une succession de formation de paires d'ions. Une partie de l'énergie est également utilisée pour former des atomes excités. L'importance relative des deux phénomènes en ce qui concerne les effets biologiques et chimiques des radiations est encore discutée. On pense généralement que les effets des radiations sur la matière sont dus pour 50 % à chacun de ces deux processus.
Quand la radiation passe dans l'air, la création d'une paire d'ions nécessite en moyenne une énergie de 35 eV. Cela signifie que la particule crée environ 30 000 paires d'ions pour chaque million d'électronvolts d'énergie initiale. En réalité, le nombre de paires d'ions créés par unité de longueur ou ionisation spécifique augmente à mesure que la particule ralentit. À la fin de son parcours, l'ionisation spécifique peut être multipliée par un facteur de 2 à 7.
L'ionisation spécifique des particules a est environ 25 fois plus élevée que celle des particules b à cause de leur masse et de leur charge plus élevées. Le pouvoir de pénétration à énergie égale en dépend tout naturellement. Les rayons a exécutent leur parcours en ligne droite alors que les b de masse beaucoup plus sont beaucoup plus facilement déviés au cours des collisions.
b- Rayons g
Une radiation électromagnétique a une probabilité beaucoup plus faible d'interaction avec la matière. On peut chiffrer approximativement à 2 500, 100 et 1 les probabilités d'interaction respectives des rayons a , b et g.
Le mécanisme d'interaction des photons peuvent agir de différentes façons. Mais puisque ces divers processus aboutissent tous à la production d'électrons, l'effet global est finalement le même que celui des rayons b. Disons seulement que les champs électrique et magnétique associés au déplacement d'un flux de rayonnement électromagnétique interagissent avec les champs respectifs associés aux charges électriques en mouvement autour des noyaux ainsi qu'avec les noyaux eux-mêmes.
La diminution totale d'intensité du faisceau est représenté par la loi classique valable pour la lumière visible :
|
15.1 |
|
Dans cette équation, µ est un coefficient qui dépend du matériau absorbant et de la longueur d'onde. Cette absorption globale est due à trois phénomènes :
|
|
Échelle logarithmique de l'énergie (MeV)
Figure 15.7. Modes d'absorption du rayonnement g par le plomb.
Tableau 15.1. Absorption comparée de divers rayonnements*
| Énergie de la particule (MeV) |
Pénétration (cm) | ||||||
| particule a | proton | électron | g | ||||
| air | Al | air | Al | air | Al | µ* dans Al | |
| 1 5 10 |
0,5 3,5 10,7 |
0,000 3 0,002 5 0,006 4 |
2,3 34 117 |
0,001 4 0,019 0,063 |
314 2 000 4 100 |
0,15 0,96 1,96 |
6,1 13,1 16,0 |
*µ: en m-1; Weidne, R.T. et R.L. Sells, Elementary modern physics, Allyn & Bacon, inc., Boston (l968). |
|||||||
- l'action photoélectrique ou production directe d'une paire d'ions surtout importante pour des photons de faible énergie (moins de 1 MeV) et des absorbeurs de numéro atomique élevé.
- l'effet COMPTON ou choc de photon sur un électron libre et production d'un autre photon.
- l'annihilation du photon et production d'une paire électron-positon. Il faut que l'énergie du photon soit supérieure à 1,02 MeV, c'est-à-dire plus que la somme des énergies des deux particules au repos 2 mo. Ce phénomène se produit au voisinage d'un noyau.
g (hn, E > 1,02 MeV) ® e- + e+
6. Unités de rayonnement
Les deux catégories d'unités suivantes sont utilisées selon le problème à traiter. La première unité est une mesure du taux de désintégration d'un élément radioactif. Dans le SI, l'unité en est le becquerel : c'est l'activité d'une matière radioactive qui subit une désintégration par seconde (symbole : Bq). Auparavant, l'élément radioactif standard était le radium. On définissait alors le Curie: c'est le nombre de désintégrations par seconde engendrées par 1 gramme de radium en équilibre avec ses sous-produits. Ce nombre est très précis :
( 3,608 ± 0,028 ) ´ 1010 .
On a cependant convenu de prendre pour valeur officielle le chiffre de 3,700 ´ 1010 désintégrations par seconde. Il s'ensuit que 1 Curie vaut 3,7 1010 sec-1.
Par contre les effets des radiations sont déterminés par la quantité d'énergie transférée au milieu. On a donc défini des unités de dose dans le but de chiffrer ces effets : c'est le gray (Gy) qui correspond à une énergie de 1 joule absorbée par 1 kg de matière. Anciennement, on définissait le röntgen comme la quantité de rayons X ou g qui produisait dans 1 cm3 d'air (sec, TPN) une unité électrostatique d'ions positifs ou négatifs.
Dans le cas où le rayonnement est constitué de particules, on définissait le Rad comme la dose quelconque de radiation ionisante qui produit une énergie absorbée de 100 ergs par gramme de tissus vivants. On préfère maintenant le sievert (Sv) : 1 sievert est la dose dont l'effet est égal à celui d'un rayonnement X de 200 à 250 kV.
La notion de dose absorbée est particulièrement importante dans le cas de l'absorption d'énergie par la matière vivante et encore plus par des tissus humains. Chaque organe humain n'est pas affecté par le rayonnement de la même manière. On définit la dose équivalente à l'organe HT,R dans un tissu T liée à un rayonnement R par la relation :
|
15.2 |
HT,R = WR ´ DT,R |
Dans cette égalité, WR est un facteur de pondération sans dimension, et
DT,R est la dose absorbée par le tissu T sous rayonnement R.
Les grandeurs HT,R et DT,R sont exprimés dans la même unité: en sievert : Sv. Le facteur sans dimension WR dépend de la nature du rayonnement (Tableau 15.2). La dose totale, HT, est la somme de HT,R pour tous les types de rayonnement. Pour un corps humain, la dose efficace ajoutée à la dose naturelle ne doit pas dépasser 1 mSv par an.
Tableau 15.2. Valeur des facteurs de pondération pour divers types de rayonnement
| Rayonnement | Facteur de pondération | ||
| photons de toutes énergies électrons et muons de toutes énergies
protons autres que protons de recul, E > 2 MeV |
1 |
||
| Henri Métivier, L'actualité chimique, Société française de chimie, 24-31, février 1998. | |||
La dose efficace, E, est la somme des doses équivalentes pour chaque organe ou tissus de l'organisme pondérées par un facteur dépendant de la sensibilité aux effets aléatoires (stochastiques) du tissu irradié WT. Ces facteurs de pondération sont normalisés et leur somme est égale à l'unité. La dose efficace s'exprime en sievert puisque le facteur est sans dimension et se calcule par la relation 15.3 (Tableau 15.3).
|
15.3 |
E = ST WT HT |
Tableau 15.3. Facteurs de pondération normalisés tissulaire pour divers organes
| Tissus spécifiés | WT | Tissus spécifiés | WT | Tissus spécifiés | WT |
| gonades poumon sein peau |
0,20 0,12 0,05 0,01 |
moelle osseuse estomac œsophage surface osseuse |
0,12 0,12 0,05 0,01 |
colon vessie thyroïde autres* |
0,12 0,05 0,050,10 |
| *:
comprend: les autres tissus : la glande surrénale, le cerveau, l'intestin grêle, les
reins, les muscles, le pancréas, le thymus et l'utérus. Tiré de : Henri Métivier, L'actualité chimique, Société française de chimie, 24-31, février 1998. |
|||||
La dose efficace limite à laquelle une personne peut être exposée est déterminée par son incidence principalement sur l'apparition des cancers. L'hypothèse de base est que toute augmentation d'exposition au rayonnement augmente la fréquence d'apparition de ces cancers. Ces doses limites ne sont pas nécessairement admises au même niveau par tous les spécialistes, et par tous les pays. La commission internationale de protection radiologique a fixé à 100 mSv sur 5 ans la limite à ne pas dépasser pour les travailleurs avec possibilité d'atteindre 50 mSv en une seule année.
La principale source d'exposition de la population vient du radon (1,25 mSv/an): environ la moitié de toutes les expositions naturelles. Les expositions au rayonnement provenant des matériaux terrestres (autres que le radon) et au rayonnement cosmique sont à peu près équivalentes : 0,4 mSv chacun. Il ne faudrait pas non plus oublier l'exposition résultante d'examens médicaux (radiographies pulmonaires, dentaires, ...) et à l'industrie : environ 1 mSv/an.
7. La contamination environnementale
L'homme est exposé de manière naturelle aux éléments radioactifs. L'absorption de radionucléides se fait principalement par la voie digestive et par inhalation. Pour les travailleurs exposés à certaine tâche, la voie cutanée, y inclus par blessure, constitue à l'occasion une voie importante d'absorption. La voie digestive et l'inhalation sont liées à la dispersion de radionucléides suite aux rejets acceptés légalement ou résultant d'accidents de l'industrie nucléaire. Les rejets en situation normale sont toujours très faibles et bien inférieurs à la radioactivité naturelle. Par ailleurs des accidents comme celui de Tchernobyl ont des conséquences désastreuses.
Dans de tels accidents, l'homme peut être irradié immédiatement par immersion dans le panache du nuage radioactif, à moyen terme par les dépôts sur le sol et à plus long terme à travers la chaîne alimentaire. Par exemple, les essais nucléaires ont laissé plus de 4 tonnes de plutonium dans l'atmosphère. Dans l'hémisphère nord, les populations ont été contaminées à raison de 10 à 20 Bq par individu. La contamination est venue en majorité (90 %) à travers la chaîne alimentaire suite au dépôt des radioéléments sur le sol. La concentration moyenne en plutonium est de l'ordre de 0,1-1 Bq kg-1 dans les couches supérieurs des sols. Autour de lieux accidentés, cette concentration peut être beaucoup plus élevée comme cela est le cas à Rocky Flats (Colorado) : 2 500 Bq kg-1. L'accident de Tchernobyl a laissé des niveaux de contamination élevés en 137Cs sur tout le territoire de l'Europe centrale : dans certains endroit supérieurs à 40 000 Bq/m2.
Le dépôt des actinides en mer ou sur terre conduit à des résultats opposés. Les organismes marins ont souvent un effet accumulateur, concentrateur comme cela est le cas pour les métaux lourds. Les produits marins qui sont consommés par l'homme, tels la moule, le bigorneau, ont des concentrations en radionucléides de beaucoup supérieures à celle de l'eau. Les algues situées au voisinage d'une usine de retraitement du plutonium dans le nord-ouest de la France ont des concentrations en plutonium de 10 à 100 000 fois plus grandes que celle de l'eau de mer.
Au contraire, sur terre, les transferts successifs ont un effet de dilution fort important. La végétation, puis les animaux qui les consomment ont des concentrations en plutonium bien souvent de 106 à 109 fois plus faibles. Le risque pour l'homme est donc négligeable. Il faut par ailleurs considérer le site de fixation des radioéléments. Le césium se fixe dans la chair et les muscles et l'iode dans le lait : des tissus ou produits de consommation humaine. Par contre, le plutonium, le strontium et le radon se fixent de préférence au niveau du squelette. Le risque est donc ici plus faible.
Mentionnons que la source d'irradiation interne la plus importante est celle du radon, radioéléments que l'on retrouve principalement dans les roches de type granitique (bouclier canadien). C'est la raison pour laquelle on demande de prévoir de bons systèmes de ventilation dans les sous-sols des maisons construites dans des zones granitiques, le radon s'infiltrant par les fissures. À ce sujet, il faut rappeler que les eaux minérales provenant de sources sises en terrain granitique sont elles aussi chargées de radionucléides, donc légèrement et à l'occasion très radioactives. Elles peuvent avoir une activité de 0,1 Bq L-1, et même de plusieurs Bq L-1. À une consommation de 1 litre d'eau minérale par jour peut correspondre une dose de 0,025 à 0,25 mSv.
La décontamination
Les processus de décontamination font largement appel à la complexation des éléments radioactifs. Supposons une ingestion d'un composé soluble : le dépôt du radioélément dans les organes se fera via le flux sanguin. Le plutonium se déposera surtout dans le foie et les tissus osseux. Compte tenu du traitement très difficile et de la longue vie du radioélément, il y a lieu d'entreprendre un traitement très rapide. On utilise le DTPA qui complexe fortement le plutonium et l'élimination se fait par voie urinaire. Le 137Cs se fixe dans la masse musculaire. Tout comme le potassium, cet élément effectue un va et vient incessant entre le plasma sanguin et la lumière intestinale. On utilise alors le bleu de Prusse qui le complexe. Le césium ainsi piégé est éliminé via les excréments. Le cas du tritium est plus simple. On élimine l'eau tritiée en buvant une quantité d'eau très supérieure à la ration journalière normale.
Un bon agent complexant, chélateur, doit former des complexes très stables dans les conditions physiologiques normales (pH, T) avec les radioéléments (Th, U, Np, Pu,..). Il doit ensuite être facilement évacué par les voies urinaire ou fécale. En contrepartie, il ne doit pas complexer les éléments essentiels à l'organisme humain (Fe, Cu, Zn, Co, Ca,...).
8. Étude de la désintégration en fonction du temps
a. la période T
Pour chaque élément, l'intensité de l'émission est directement proportionnelle à la masse de l'échantillon. Cette observation montre qu'il n'y a aucune influence réciproque entre les atomes; chacun émet donc comme s'il était seul. Nous appellerons activité un nombre caractérisant l'intensité de l'émission mesurée par l'un des appareils classiques. La courbe expérimentale d'activité en fonction du temps est représentée par la formule :
|
15.4 |
n = n0 e-l t |
Dans cette équation n est l'activité instantanée, n0 l'activité initiale, l la constante radioactive. Cette constante est caractéristique de l'élément émetteur. La période T est le temps pendant lequel l'activité de l'élément diminue de 50 % :
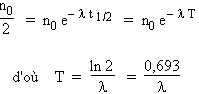
Tableau 15.4. Quelques périodes d'éléments radioactifs
| Noyau | T | type de
rayonnement |
Noyau | T | type de rayonnement |
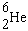 |
0,802 s | e- |
|
1,3 m | a et g |
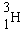 |
12,3 ans | e- |
|
7,1 108 ans | a et g |
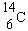 |
5 730 ans |
La période, liée directement à l est donc une caractéristique d'un élément. La période peut être très longue comme dans le cas de l'uranium-238 dont la période est de 4,51 109 ans ou celle du thorium C' (polonium-212) qui est de 0,3 microsecondes. L'activité d'une substance radioactive n'est pas altérée par les variations de pression ou de température. Les énergies mises en jeu dans une réaction nucléaire sont de l'ordre de plusieurs MeV. Les variations kT sont plutôt de l'ordre de quelques dixièmes d'électronvolts. Il n'y a donc pas d'interaction entre la température et les réactions nucléaires.
La loi de désintégration radioactive est utilisée pour mesurer l'âge de divers objets. C'est le cas du carbone-14 qui donne lieu à la méthode de datation au carbone-14 (W.F. Libby). Ce carbone-14 est formé en haute altitude par une réaction de capture neutronique par l'azote. Le carbone formé est radioactif.

La période du carbone 14 est de 5 580 ans. Il s'ensuit que le carbone-12 contient une concentration à l'équilibre de carbone-14. Cet équilibre est évidemment contrôlé par la vitesse de formation et la période de ce carbone-14. Le végétal respire le gaz carbonique qui contient des traces de ce carbone radioactif. De cette sorte, la matière végétale contient un rapport constant 14C/12C pendant toute sa vie. Au moment de sa mort, le végétal cesse ses échanges avec l'air ambiant et alors la concentration en carbone-14 diminue lentement. La mesure du rapport 14C/12C permet d'évaluer l'âge de l'objet d'origine végétale : " artéfacts " en bois, alcools de vin, charbon de bois ayant servi dans les peintures, . . . etc.
b. l'équilibre entre substances radioactives
Un noyau qui se désintègre par émission a ou b produit un noyau de nature différente, c'est-à-dire un élément qui ne correspond plus à la même masse atomique ou au même numéro atomique. Cet élément, à son tour peut être radioactif et se désintégrer avec une période différente du premier et ainsi de suite. Prenons l'exemple classique du radium (période 1 500 ans) qui se désintègre en radon (période de 3,82 jours) qui lui-même se désintègre en continuant la série. Si on place du radium pur dans un récipient fermé, la quantité de radon atteint une limite qui ne pourra être dépassée. Cette limite correspondra à l'état d'équilibre radioactif. Cet équilibre est atteint lorsque le nombre d'atomes de radon formé par unité de temps est égal au nombre d'atomes de radon qui se désintègrent pendant le même temps. Le nombre d'atomes de l'élément père désintégrés pendant le temps dt est obtenu en dérivant l'expression 15.4 :
dnp = lp np dt
Ce nombre est égal au nombre de l'élément fils créé pendant le même temps. En outre, le nombre d'atomes de l'élément fils qui se désintègrent pendant le même temps est donné par la formule homologue :
dnf = lf nf dt
L'équilibre à lieu lorsque ces deux nombres sont égaux (dnp = dnf). Il s'ensuit que :
|
15.5 |
|
Les activités instantanées étant proportionnelles au nombre d'atomes, on peut en déduire que 15.5 donne le rapport des concentrations à l'équilibre. Cette formule est générale et applicable à tous les maillons d'une série radioactive. Elle indique que plus la période d'un élément est grande, plus la concentration relative de cet élément est grande.
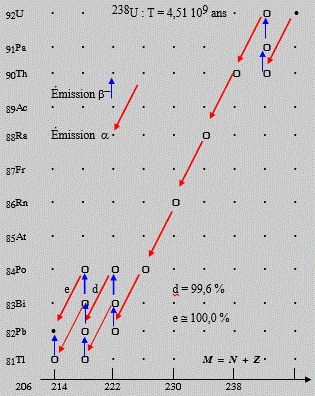
9. Séries radioactives
La plupart des radioéléments naturels sont le résultat de désintégration en série à partir d'un élément initiateur de la série. On connaît trois séries naturelles amorcées par trois éléments différents. Ce sont :
 |
 |
|
| Figure 15.8A. Série radioactive paire : 4N. | Figure 15.8B. Série radioactive paire 4N + 2. |
 |
 |
|
| Figure 15.9A. Série radioactive impaire 4N + 3. | Figure 15.9B. Série radioactive impaire 4N+ 1. |
La série 4n + 1 n'existe pas pour la simple raison que l'élément père, le neptunium 93 a une période trop courte (T = 2,14 106 ans) de telle sorte que la famille s'est éteinte depuis longtemps (Fig. 15.9B)..
Tableau 15.6. Quelques éléments radioactifs naturels
n'appartenant pas à l'une ou l'autre des quatre séries radioactives naturelles
| Isotope radioactif | Abondance (%) |
Période (années) |
Mode de réaction | Produits stables |
 Notes: c. e.: capture électronique; 1: Élément naturel qui a un temps de demie-vie le plus long jamais mesuré, plus long que l'âge de l'univers. |
||||
Un certain nombre d'éléments radioactifs naturels n'appartiennent pas ces séries. Quelques uns d'entre eux apparaissent dans le tableau qui précède. On notera que les périodes sont très longues. S'il en était autrement il y a longtemps que ces éléments auraient disparus.
|
Il existe plusieurs appareils qui permettent l’observation de la disparition des noyaux instables. La mise en œuvre de ces appareils dépend du type de rayonnement que l’on veut observer. Les rayonnements alpha, beta et gamma sont les principales particules émises lors de la disparition des noyaux instables (radioactifs). Le pouvoir pénétrant est faible pour le rayonnement a et très élevé pour le rayonnement g. L’adsorption de ces rayonnements suit une loi du type inverse carré de la distance. Le rayonnement g produit différents sous-produits dépendant de son énergie initiale : effet photoélectrique et effet COMPTON, production de paires d'électron-positon. La loi de désintégration radioactive suit une loi exponentielle de telle sorte que la moitié des noyaux instables ont disparu après un temps identifié à la période de l’élément émetteur. Cette période étant caractéristique de chaque élément émetteur, on a pu mettre au point des horloges qui permettent de dater certains événements sur quelques années, sur quelques siècles ou sur les âges géologiques. Finalement, les noyaux instables sont pour la majorité les enfants, les petits enfants de trois noyaux instables dont la durée de vie est de l’ordre du milliard d’années de telle sorte qu’ils n’ont pas eu le temps suffisant pour disparaître complètement.
|
| 9.1 | Établissez les réactions nucléaires suivantes : - le plomb 214 qui émet un rayonnement
b, |
| 9.2 | On aimerait connaître la teneur en eau du corps humain. Pour ce faire, on utilise l'isotope 3 de l'hydrogène comme traceur radioactif: le tritium. Celui-ci se transforme spontanément en hélium 3 en émettant une particule ß- avec une période de 12,5 ans. On injecte donc à un homme de 70 kg exactement 5,0 cm3 d'eau contenant de l'oxyde de tritium T2O. Au bout de quelques heures, on prélève une petite quantité de sang et après avoir éliminé les globules par centrifugation on constate que 1,0 cm3 de sérum émet environ 180 000 particules ß- par minute. Sachant que les 5,0 cm3 d'eau tritiée émettaient 9 milliards de particules à la minute, calculer la proportion d'eau dans le corps humain. |
Réponse : 71 %.
| 9.3 | Le cycle naturel de formation du carbone 14 fait qu'en moyenne le carbone présent dans la matière végétale vivante a une activité de 15,3 désintégrations de 14C par minute et par gramme de carbone. L'étude des célèbres peintures des grottes de Lascaux (France) montre que le charbon de bois qui y fut utilisé manifeste 2,22 ± 0,24 désintégrations par minute et par gramme de carbone. En déduire l'âge de ces fresques et évaluer l'incertitude de cette détermination. |
Réponse : 15 600 ± 800 ans.
| 9.4 | On a remarqué que, généralement, dans une série d'isotopes d'un élément, ceux des plus légers sont radioactifs et se transmutent en émettant un positon et ceux des plus lourds le sont en émettant un électron. Dans le cas de l'iode, compléter selon ce modèle les réactions nucléaires suivantes :
À l'aide du modèle nucléaire en couche, expliquez cette tendance dans le cas des trois isotopes de l'iode tout juste mentionnés. |
||||||||
| 9.5 | Un déchet nucléaire a une demi-vie de 22 heures. En combien de temps l'activité de ce déchet sera réduite à 1 % de sa valeur initiale. Même calcul pour un sous-produit dont la période est de 100 ans. |
| 9.6 | Les batteries d'un "pacemaker" contiennent du plutonium-238 dont le temps de demi-vie est de 27,1 années. Si l'échantillon initial contient 2,57 109 atomes de combien de temps s'écoulera avant que le nombre d'atomes soit réduit à 5,02 108 atomes ? |
| 9.7 | On admet que le radium radioactif, en se désintégrant, produit 4 rayons a. En introduisant dans une ampoule de 5 cm3, scellée sous vide, 1 g de radium (poids atomique 226 g), quelle sera la pression dans la cellule après une année, après 10 ans ? Exprimez les résultats en Pascal et en mmHg. On indique que la période de cet élément est de 1 600 ans. |
| 9.8 |
Dans une série radioactive en équilibre du type A*
®
B*
®
C*
®
D*
®
E(stable), on observe les rapports des concentrations suivantes :
[B] /[C]
= 2 108
et [C] /[D]
= 1,45
Si la période de B* est de 105
années, calculez en heures les
périodes de C et de D. |
Exemples de lectures complémentaires
Lefort, M., Les radiations nucléaires, Collection "Que sais-je?", Presses universitaires de France, nº 844, 1959.
Bouzat, A., L'énergie atomique, Collection "Que sais-je?", Presses universitaires de France, nº 317, 1963.
Kahan, T., Les particules élémentaires, Collection "Que sais-je?", Presses universitaires de France, nº 1293, 1969.
Bonet-Maury, P., La radioprotection, Collection "Que sais-je?", Presses universitaires de France, nº 1347, 1969.
Guérin, J., L'énergie nucléaire, Collection "Que sais-je?", Presses universitaires de France, nº 317, 1973.
Moe, M. K. et S. P. Rosen, Double-Beta Decay, Scientific American, 48-55, Novembre 1989.
Métivier, H., Que deviennent les radionucléides chez l'homme et dans son environnement?, L'Actualité chimique, Paris, 24-31, (février 1998).
Lemonick, S., Xenon-124 sets half-life record, Chem. & Engin. News, 9, (6 mai 2019).
Un site web général en français (avec une approche mathématique plus
développée) en provenance de la Suisse :
http://www.sciences.ch/htmlfr/physatomique/physatomphysnucl01.php
(visité le 2019-02-19)
Des Prix Nobel :
BECQUEREL :
https://www.nobelprize.org/prizes/physics/1903/becquerel/facts/
(visité le 2019-02-19)
SODDY :
https://www.nobelprize.org/prizes/chemistry/1921/summary/
(visité le 2019-02-19)
Dernière mise à jour : 2023-07-26.
__________________________________