Þ
et [3.9] |
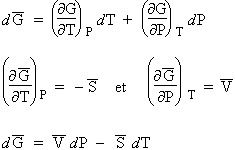 |
|
Dans une transformation, une partie seulement de l’énergie d’un système peut être utilisée, le produit T DS mesurant l’énergie inutilisable. On peut donc définir une fonction Énergie libre telle que DG = DH - T DS. Tout comme l’enthalpie, on ne peut connaître la valeur absolue de cette énergie libre. Comment varie cette fonction avec les paramètres habituels que sont la température et la pression ?
|
On a, au Chapitre III, introduit brièvement la notion d’entropie, S, ainsi que celle de l’énergie utilisable, G, la fraction de la chaleur transformable en travail utilisable :
G = H - T S
ou mieux, puisque les valeurs absolues des fonctions thermodynamiques ne sont pas accessibles :
DG = DH - T DS .
Tout comme l’enthalpie et l’entropie, l’énergie libre dépend de la température et de la pression. À ce propos, il faut rappeler que la variance d’un système (voir Chapitre VII.2b) est telle que u = C + 2 - j. Pour un système à un constituant, puisqu’il y a au moins une phase, la variance est au plus de 2 : il faut déterminer deux paramètres pour déterminer le système. Ce sont la température et la pression. On pourrait tout aussi bien choisir la température et le volume. Comme bien souvent, le volume est fixe, les paramètres d’usage sont la pression et la température, de telle sorte que la fonction énergie libre dépend de la température et de la pression : G = ƒ(T,P).
2. Relations entre enthalpie et énergie libre
Si la fonction énergie libre est elle même fonction de la température et de la pression, si G = ƒ(T,P), (voir le théorème d’EULER) les équations [3.3] et [3.10] sont :
Þ
et [3.9] |
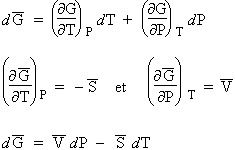 |
On peut donc calculer pour une réaction ou une transformation donnée, la variation d’énergie libre si l’on connaît à la fois les variations correspondantes d'enthalpie et d'entropie, DH et DS et la température à laquelle a lieu cette transformation. La dernière formule, [3.9], permet d’atteindre le même résultat en connaissant DS et le volume molaire. Parfois, cependant, seules les variations de DH sont disponibles.
| [4.1] [4.2] |
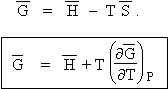 |
En se
rappelant
[3.10], il
vient
|
C’est l’équation de GIBBS-HELMOLTZ énoncée en 1872. La même équation peut s’appliquer aux variations de grandeurs thermodynamiques, par exemple celles survenant au cours d’une réaction chimique, donc en changeant les fonctions G et H par leur variation DG et DH. On peut aussi calculer les équations suivantes :
A- Dérivons la fonction G/T par rapport à la température T, on obtient :
| [4.3]
Or, d'après la relation [4.2] Þ
|
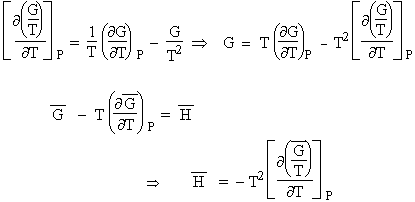 |
ou encore
| [4.4] |
|
B- De la même manière, dérivons la même fonction G/T cette fois par rapport à 1/T, on obtient :
|
|
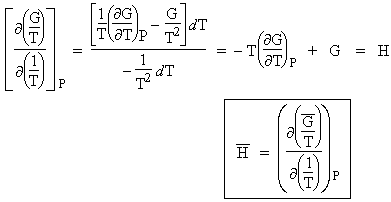 |
L’usage de l’une ou l’autre de deux relations liant les fonctions enthalpie et énergie libre molaires
![]()
qui viennent d’être établies, permettent de calculer ces deux dernières valeurs, bien entendu dans la mesure où la fonction
|
|
est connue. |
3. Signification physique de DG
Étant données les significations physiques de DH, DS et de DG et compte tenu des conventions de signe, la variation de l’énergie libre, DG, permet de prévoir le sens d’une réaction :
si DG < 0, la réaction peut avoir lieu dans le sens où elle est écrite DSunivers > 0*,
si DG = 0, la réaction est à l’équilibre DSunivers = 0* et finalement,
si DG > 0, la réaction va dans le sens inverse où elle est écrite DSunivers < 0*.
* : voir chapitre 3.1.
Il faut rappeler que si DG < 0, la réaction peut ne pas évoluer naturellement. En effet, si la thermodynamique prédit le sens d’une réaction, elle n’en prédit pas la vitesse. Un cours de cinétique permet de calculer ces vitesses de réaction. La cinétique tient compte des barrières de potentiel qui s’opposent au bon déroulement des réactions (Fig. 4.1).
|
|
Figure 4.1. Diagramme des coordonnées de la réaction.
4. Variation de l’énergie libre avec la pression
On a déjà vu le théorème d’EULER, équation [3.10], que
![]()
En se rappelant que
![]() ,
pour un gaz parfait, l’intégration de cette équation
conduit à :
,
pour un gaz parfait, l’intégration de cette équation
conduit à :
| [4.6] Þ ou [4.7] |
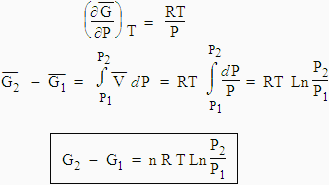 |
Cette équation est valide pour un gaz parfait. On verra plus tard l’application de cette loi.
5. Tables d’énergie libre
Tout comme pour l’enthalpie et l’entropie, on trouvera des tables d’énergie libre standard de formation des différents composés chimiques. Notons que ces tables ne sont pas indispensables puisque si l’on dispose des tables correspondantes relatives à l’enthalpie et à l’entropie, on saura retrouver les valeurs de l’énergie libre standard de formation.
| 6. Conclusions
Plusieurs relations mathématiques existent entre les fonctions enthalpie et énergie libre. La relation de GIBBS-HELMOLTZ et le théorème d’EULER permettent d ’établir plusieurs de ces relations mathématiques. Le signe de la variation de l ’énergie libre permet de connaître le sens naturelle d’une transformation :
si DG < 0, la réaction peut avoir
lieu dans le sens où elle est écrite ;
|
7.1. Réaction de dissociation du soufre
La réaction S2 (g) ![]() 2 S (g) admet les
relations suivantes :
2 S (g) admet les
relations suivantes :
Ln Kp = - 38,54 à 1000 K et
|
|
= 428 870 + 10,32 T - 1,86 10-3 T2 joules |
Trouvez quelle sera la proportion de soufre moléculaire qui sera dissocié à 4 000 K sous la pression atmosphérique.
Réponse : 75 % du soufre moléculaire est dissocié à 4 000 K.
7.2. L’équilibre entre l’hydrogène sulfuré et ses constituants
2 H2 (g) + S2 (g) ![]() 2 H2S (g)
2 H2S (g)
La variation de l’énergie libre de la réaction d’hydrogénation du soufre est indiquée dans la relation qui suit :
|
|
= - 162 225 + 27,97 T Ln T - 8,63 10-3 T2 - 104,6 T (joules) |
En déduire les expressions de
![]()
Réponses : Ln Kp = 19 522 / T - 3,37 Ln T + 1,04 10-3 T + 12,59
DH = - 162 225 - 27,97 T + 8,63 10-3 T2 (joules).
7.3. Réaction d’oxydation du soufre
Soit la réaction 2 O2 (g) + S2 (g)
2 SO2 (g)
On donne :
= 722,72 k J · mol-1 = - 140,74 J · mol-1 · K-1 et = - 6,23 + 5,95 10-3 T - 1,40 10+5 T-2 J · mol-1 · K-1 Trouver la valeur de la variation de l’énergie libre, DG° , à 1000 K, ainsi que la valeur de la constante de l’équilibre Kp.
Réponse : KP = 2,25 1030 atm-1
Dernière mise à jour : 2015-06-15.
X X X X X X X