|
|
+ |
|
® |
|
|
Objectifs Le chapitre précédent a traité principalement de la séparation des deux liquides miscibles en toutes proportions et des procédés de distillation. Intuitivement ou expérimentalement, on sait déjà qu’il existe des paires de solides complètement solubles l’un dans l’autre, d’autres pairs totalement insolubles avec probablement des situations intermédiaires. Questions : - Comment peut-on décrire et caractériser les équilibres entre les deux phases des deux solides purs ? - Existent-ils des états intermédiaires ? Quelles sont leurs propriétés ? - Bien évidemment, comment peut-on de ces mélanges binaires obtenir les constituants à l’état pur ? Objectifs : - Comprendre le mode de formation des solutions solide ; - Connaître la complexité des diagrammes binaires ; - Connaître les principales applications. |
1. Rappels - La règle des phases
1- Définitions
a- phase j : Une phase est toute partie homogène d’un système physiquement distincte des autres parties dont elle est séparée par des surfaces de délimitation bien définies.
b- nombre de composants C :
Chaque phase contient un nombre d’espèces bien définies. Le nombre de composants est ce nombre d’espèces diminué du nombre de relations chimiques qui les relient.
Nota : ne pas confondre composant et composé !
c- variance u : Lorsque le nombre de composants d’un système et les composants de chacune des phases sont précisés, c’est le nombre de facteurs qu’il faut préciser pour que l’équilibre soit défini.
Nota : la variance est aussi appelée le nombre de degré de liberté du système.
2- Calcul théorique de la variance (voir le Chapitre VII.2-b) :
|
3- Cas particuliers.
Dans le cas où la phase gazeuse n’intervient pas, le paramètre pression n’intervient pas puisque les solides et les liquides sont réputés incompressibles :
u = C + 1 - j
C’est le cas des courbes de fusion, des transformations allotropiques.
2. Diagrammes binaires solides-solides
|
|
+ |
|
® |
|
Figure 11.1. Formation d’une solution solide interstitielle.
2.a Les solutions solides
Il est difficile de prévoir l’allure d’un diagramme quel que soit le mélange binaire aussi simple et, a fortiori, aussi compliqué soit-il. On peut cependant classer les solutions solides en deux catégories que sont les solutions interstitielles et les solutions par substitution. Dans le premier cas (Fig. 11.1), les atomes d’un soluté B viennent s’installer dans les interstices, dans les cavités disponibles entre les atomes du solvant A. Ces solutions ne sont possibles que si le diamètre des individus B est très inférieur à celui des cavités disponibles dans le réseau cristallin du solvant A. En général, les atomes ou molécules B ont un diamètre beaucoup plus petit que ceux ou celles de A.
Un cas intéressant et particulier est celui de l'insertion, de l'intercalation de divers éléments entre les plans carbonés du graphite. Ce matériau est constitué de plans de structure hexagonale très stable (liaisons fortes de nature covalente). Inversement, ces plans s'ajoutent les uns sur les autres et sont liés par des liaisons de type Van der Waals, donc faibles.. Cette structure permet l'intercalation d'atomes ou de molécules diverses dont le diamètre est plus élevé que celui des seuls atomes de carbone.
Dans le second cas, les atomes B viennent prendre la place, viennent substituer les atomes A dans le réseau cristallin (Fig. 11.2). Cette situation ne peut pas toujours se réaliser . Expérimentalement on observe que pour qu’il y ait miscibilité réciproque complète, de A dans B et de B dans A, il faut qu’un certain nombre de conditions soient respectées :
i- les diamètres d des individus A et B sont voisins : la différence maximum tolérable est de ± 15 %. On traduit cette réalité en disant que le facteur de dimension doit être inférieur à 15 % :
![]()
ii- Les deux composés A et B cristallisent dans le même système cristallin.
iii- Les valences ou degré d’oxydation de A et de B sont les mêmes.
Tout écart à ces trois conditions fait apparaître, fait croître, la non miscibilité réciproque.
Un cas intéressant est celui de l'isertion de divers éléments entre les plans carbonés du graphite. Ce matériau est constitué de plans de structure hexagonale (liaison forte de nature covalente) très stables. Ces plans s'ajustent, s'empilent les uns sur les autres et sont liés par des liaisons de type Van der Waals, donc faibles. Cette stucture permet une intercalation de divers atomes ou molécules coincées en "sandwich".
 |
+ |  |
® |  |
Figure 11.2. Formation d’une solution solide par substitution.
la loi de VÉGARD :
Dans le cas de solutions solides où il y a miscibilité sur toute l’échelle de concentration, le paramètre d de la maille élémentaire de la solution solide varie de façon linéaire entre les paramètres respectifs des deux composés purs.
d = dA ´ (% atomique de A + dB ´ (% atomique de B) |
Cette loi pour les solutions solides est l'équivalent de la loi de RAOULT pour les solutions liquides : équation [8.35]. La figure suivante montre une série d’exemples de divers carbures métalliques qui suivent la loi de VÉGARD lorsqu’ils constituent deux à deux des mélanges binaires. Le tableau 11.1 complète cette figure en donnant les grandeurs des mailles élémentaires des structures cristallines correspondantes (isotypes du NaCl, donc de structure cubique à faces centrées).
Tableau 11.1. Dimensions des mailles élémentaires de divers carbures métalliques
MC |
V4C3 |
VC |
Ti4C3 |
TiC |
ThC |
TaC |
NbC |
HfC |
ZrC |
PuC |
UC |
×10 nm |
4,136 |
4,182 |
4,30 |
4,327 |
4,329 |
4,457 |
4,466 |
4,626 |
4,689 |
4,948 |
4,965 |
Il y a bien sûr de nombreux autres exemples (voir en particulier le tome XX du Pascal). Bien évidemment, il existe des cas où l'on observe des écarts très importants à la loi de VÉGARD au fur et à mesure que les conditions mentionnées plus haut tiennent de moins en moins. Il existe des exemples particuliers qui méritent d’être mentionnés. C’est le cas du système Pd-Pt qui présente un écart relativement important (Fig. 11.4) alors que les systèmes Pd-Au et Pt-Au respectent scrupuleusement cette loi de VÉGARD.
|
|
Figure 11.3. Variation de la dimension de la maille élémentaire
dans le cas de solutions solides de carbures métalliques.
(Réf. : PASCAL, Tome XX, pages 1,349, 370, 374 et 375)
|
|
Figure 11.4. Variation de la dimension de la maille élémentaire du
système Pd-Pt
en fonction de la composition.
|
|
Figure 11.5. Variation du champ de ligand du système Al2O3-Cr2O3
en fonction de la composition.
Piézochromisme, thermochromisme
La loi de VÉGARD peut être appliquée à d’autres propriétés que la dimension de la maille élémentaire. À cet égard, le diagramme binaire Al2O3-Cr2O3 mérite aussi quelqu’attention. L’alumine Al2O3 est incolore (saphir). L’ajout de traces d’ions Cr+++ colore le cristal en vert puis à 2,2 % de Cr2O3 le cristal devient rubis. Vers environ 25 %, la couleur passe du rouge au gris puis au vert. Pour des concentrations atomiques supérieures à 25 %, le cristal reste vert. L'atome de chrome CrIII est un peu plus gros que celui de l'aluminium AlIII. Ces variations dans les couleurs ne semblent donc pas suivre la loi de VÉGARD alors que la variation du champ de ligand y est conforme (Fig. 11.5). Mentionnons que ces variations de couleurs font référence à des transitions électroniques et donc à des déplacements dans les spectres d’absorption optique. Ce système cristallin est à cet égard bien particulier. Si, par exemple, un cristal Al2O3-Cr2O3 (40%-60%) est normalement vert, sous une pression de 100 kbars, il devient rouge : c’est la propriété de piézochromisme. De la même manière, un cristal contenant 10 % d’oxyde de chrome et le complément en oxyde d’aluminium qui est rouge à la température normale passe progressivement au gris puis au vert lorsque la température franchit la région de 400 ºC : c’est la propriété de thermochromisme.
Dans le cas du système Fe2O3-Cr2O3 (CrxFe2-xO3), le point de NÉEL antiferromagnétique (voir le cours de Chimie théorique, Chapitre 17.6) varie linéairement avec x de 948 K (x = 0) à 503 K (x = 0,9) et continue à diminuer lentement jusqu’à une valeur de x égale à 1,52. Pour des valeurs de x supérieures à 1,52, la transition antiferromagnétique n’existe plus.
2.b Premier type de diagramme - miscibilité totale et réciproque
Soit un mélange de deux composés A et B solubles l'un dans l'autre en toute proportion en phase solide. Leurs températures de fusion sont respectivement TA et TB. Le diagramme type apparaît à la figure 11.6.
|
|
Figure 11.6. Diagramme binaire avec facteur de structure < 15%.
|
|
Figure 11.7. Établissement des courbes de refroidissement.
Les courbes de refroidissement :
La détermination expérimentale de la forme exacte d’un diagramme peut se faire de plusieurs manières. L’observation de l’apparition de la première goutte de liquide par chauffage d’un mélange solide n’est pas une méthode précise car, en général, la cinétique des processus en phase solide est lente. La détermination des courbes de solidus par cette méthode n’est donc pas précise.
La détermination expérimentale des courbes de refroidissement : élimine ou atténue l’effet du retard cinétique. Un mélange solide est rapidement porté à l’état liquide, point L de la figure 11.7. On le laisse se refroidir lentement. Typiquement les vitesses de refroidissement sont de l’ordre de 2 à 5 ºC/min. Lorsqu’il se refroidit, l’échantillon perd une quantité q d’énergie par unité de temps. S’il y a en même temps cristallisation, ce processus dégage de l’énergie et retarde le refroidissement. La vitesse de refroidissement est donc ralentie et l’on observe un bris dans la courbe de refroidissement. Cette brisure, point M, correspond à la température de la courbe du liquidus. Lorsque la cristallisation est terminée, point N, il n’y a plus dégagement interne d’énergie et la courbe de refroidissement reprend sa pente originale. La nouvelle cassure correspond à la température du solidus. À l’intérieur, entre les courbes de liquidus et de solidus, la température de cristallisation n’est pas fixe : elle varie puisque l’application de la règle de la variance indique que le système est monovariant :
u = C + 2 - j = 2 + 1 - 2 = 1
Cette remarque doit être rapprochée de la forme de la courbe de refroidissement d’un composé pur. L’application de la règle de la variance indique que le système pur est invariant pendant la solidification :
u = C + 2 - j = 1 + 1 - 2 = 0
Les atomes ou molécules constitutives des systèmes cristallins A et B ont un facteur de dimension < 15%.
La préparation du silicium pour l’électronique
Le silicium de grande pureté peut être préparé par voie chimique. Le silicium est d’abord transformé en tétrachlorure de silicium volatil. On le purifie par distillation. Ce constituant est alors réduit par de l’hydrogène. On obtient un métalloïde qui peut contenir moins de 0,1 % d’impuretés. Ce niveau est beaucoup trop élevé pour son utilisation dans des applications de l’électronique. On le purifie par le procédé de fusion de zone.
Le principe repose sur le fait que les impuretés sont beaucoup plus solubles dans la phase liquide que dans la phase solide comme le montrent les courbes de liquidus et de solidus de la figure 11.8.
|
|
Figure 11.8. Cas du silicium et d’une impureté.
À une température T légèrement inférieure à la température de fusion du silicium, l’impureté majeure est plus soluble dans le liquide que dans le solide. Soient y la concentration de l’impureté dans le liquide et x celle dans le solide. On définit un coefficient de distribution ou de partage, R = x / y. Les valeurs de R vont de 0,85 pour le bore à 0,35 pour le phosphore, mais aussi de 0,04 pour l’antimoine à 0,000 5 pour l’indium.
Concrètement, l’opération est menée sur un barreau de silicium autour duquel glisse lentement (quelques mm/h) un four à induction. La zone liquéfiée se déplace à la vitesse du four de gauche à droite par exemple. Toutes les impuretés se déplacent vers l’extrémité droite du barreau, extrémité dont on se débarrassera. Dépendant du niveau de pureté recherchée, de 10-5 à 10-10 %, il faut reprendre l’opération plusieurs fois.
2.c Second type de diagramme - miscibilité totale et facteur de dimension
La miscibilité est complète et réciproque dans les phases solides et liquide. Cependant à basse température la solubilité réciproque est limitée et deux phases a et b de même structure cristalline apparaissent (Fig. 11.9A). La phase a est riche en A et la phase b est riche en B. La détermination du diagramme se fait toujours à l’aide des courbes de refroidissement. Il faut noter le point particulier correspondant au minimum commun des courbes de solidus et de liquidus. Pour un mélange de composition identique à celle correspondant à ce minimum, la courbe de refroidissement sera identique à celle observée pour un composé pur.
Exemples |
Cu-Mn |
As-Sb |
Mn-Ni |
KNO3-NaNO3 |
Na2CO3-K2CO3 |
Co-Mn |
Au-Cu |
AgBr2-HgI2 |
|
|
Figure 11.9A. Diagramme binaire avec facteur de structure > 15 %. |
Figure 11.9B. Diagramme binaire rare. |
Le diagramme "inverse" est relativement rare. Quelques cas sont cependant connus comme celui du système binaire d-carvoxime - l-carvoxime (Fig. 11.9B).
Remarque : le diagramme apparaissant en figure 11.10a n’est pas possible. En effet, supposons qu’à une température T on n’ait qu’une seule phase solide et qu’à une température T' on ait deux phases solides et qu’il faille atteindre une température T" pour obtenir le liquide. Autrement dit, sur cette figure, les courbes de liquidus et de solidus à leur minimum ne seraient pas tangentes. Si l’on a coexistence de deux phases solides et d’une phase liquide, la variance est nulle et le système, dont la température, est complètement déterminé. Il s’ensuit que les points M, I et N du graphe sont confondus. Les deux courbes de liquidus et de solidus à leur minimum acceptent la même tangente (Fig. 11.10b).
|
|
Figure 11.10a. Diagramme hypothétique impensable.
|
|
Figure 11.10b. Diagramme réel.
2.d Troisième type de diagramme - le système eutectique
La solubilité devient beaucoup plus limitée dans les phases solides et liquides et de plus les courbes solidus-liquidus et la binodale de solubilité en phase solide se rejoignent et forment ce que l’on appelle un segment eutectoïde CD. La détermination du diagramme se fait toujours à l’aide des courbes de refroidissement (Fig. 11.11A).
|
|
Figure 11.11A. Diagramme
d’un eutectique.
(Température en fonction de la composition)
Supposons que l’on dispose d’un mélange A-B de composition identique à celle du point eutectique E. Portons-le à une température supérieure à Teu, la température de la transformation eutectoïde. En refroidissant ce liquide à la température Teu, des cristaux de la phase a et de la phase b apparaissent : c’est le mélange eutectique. L’application de la règle des phases indique que le système est invariant (la température est fixe) tant et aussi longtemps qu’il y a coexistence des trois phases. L’analyse microscopique de cette phase solide est caractérisée par un enchevêtrement de fins cristaux des deux phases. Lorsque le liquide est complètement cristallisé, le système redevient monovariant et la température baisse à nouveau. Si au contraire, on dispose d’un échantillon de composition donnée par le point F, en le refroidissant, au point G apparaît un dépôt primaire qui est constitué de cristaux de la phase b. Entre les points F et G, le système est monovariant, il se forme de gros cristaux de la phase b et la température diminue progressivement jusqu’à la température Teu. À ce moment il se forme le mélange eutectique. Le système demeure à la même température pendant tout le temps de la transformation eutectoïde. La cristallisation terminée, la température recommence à diminuer. L’analyse microscopique montre la présence en fin de cristallisation de cristaux relativement gros de phase b et un mélange de fins cristaux de a et de b.
Exemples |
Bi-Pb |
AgCl-CuCl |
Cd-Zn |
KNO3-NaNO3 |
Cd-Sn |
AgI-HgI2 |
KNO3-Th(NO3) 2 |
Il existe des cas où la solubilité en phase solide est totalement absente.
Exemples |
Bi-Cd |
AgCl-KCl |
Sn-Pb |
Au-Si |
ou présente dans une seule phase.
Exemples |
Au-Ge |
Ag-Pb |
Ag-Bi |
… |
On peut aussi démontrer que le diagramme apparaissant sur la figure 11.11B est impossible.
|
|
Figure 11.11B. Diagramme impossible
(Température en fonction de la composition).
Diagramme de TAMMANN
La détermination du segment eutectique peut se réaliser à travers l’étude des courbes de refroidissement. Supposons que l’on puisse disposer de divers mélanges A-B de masse identique mais de composition différente. Toutes les courbes de refroidissement qui passent par la formation du mélange eutectique donnent lieu à la présence du plateau de température correspondant. Soient M et N les extrémités du segment eutectique et P la composition eutectique (Fig. 11.12 B). Les compositions xM, xN et xP sont inconnues. Soit un mélange dont la composition globale est située entre les compositions xM et xP et représentée par le point L. Lors de la solidification et au moment où la température atteint la température eutectique, donc au moment où débute le plateau de solidification eutectoïde, IJ, la quantité de liquide qui reste à solidifier est proportionnelle au segment MQ où Q représente la projection du point de composition globale sur le segment eutectique. Le temps de la solidification ou la durée du plateau eutectoïde est donc proportionnel au segment MQ. Sur un axe vertical descendant, portons cette durée de plateau de solidification exactement à l’abscisse correspondante à la composition globale originale et posons pour ce faire l’origine du temps zéro sur le segment eutectique. On trace ainsi le segment QT.
En procédant avec divers mélanges initiaux, on obtiendra une série de points T1, T2, T3... Par ces points on fait passer une droite qui intercepte nécessairement le segment eutectique en M (Fig. 11.12 A). On obtient une droite similaire pour les mélanges de composition comprise entre les valeurs xP et xN. L’interception de cette nouvelle droite avec le segment eutectoïde détermine le point N et l’intersection G des deux droites détermine la composition eutectoïde, donc la position du point P (Fig. 11.12 C).
|
|
|
|
Figure 11.12. Élaboration du diagramme de TAMMANN.
Application à la purification par cristallisation.
Soit, par exemple à séparer l’iodure de potassium de sa solution aqueuse. On peut procéder de façon isotherme (Fig. 11.13). À partir du point M, on évapore sans changement de température. On atteindra le point N où apparaissent les premiers cristaux. En poursuivant l’évaporation de manière isothermique, on obtiendra éventuellement le sel pur. En procédant par refroidissement de la température, au point K les premiers cristaux apparaîtront. Lorsque la température atteindra la température eutectique, le sel et la glace précipiteront dans le mélange eutectique. On doit donc arrêter l’opération avant d’atteindre cette température. Il faut donc accepter de ne pas séparer tout l’iodure de potassium.
|
|
Figure 11.13. Diagramme température
composition du mélange eau - iodure de potassium :
extraction du sel pur.
Cette méthode de séparation par cristallisation s’applique aussi à la séparation d’une paire d’énantiomères cristallisant sous la forme de conglomérat dans la mesure où le diagramme eutectique est très dissymétrique. On remarquera que les deux solides cristallins sont complètement non miscibles (Fig. 11.14).
|
|
Figure 11.14. Diagramme eutectoïde
d’énantiomères de
type conglomérat :
cas de la hydrobenzoïne : Tfus(+) = Tfus(-) = 147,5
et Teut : 121 °C.
Il existe des cas où les deux solides cristallins sont miscibles : ils sont appelés " racémiques ". Il arrive à l’occasion que la température de fusion mélange racémique soit très proche de la température de fusion de l’eutectique et donc plus bas que celui de chacun des énantiomères.
2.e Quatrième type de diagramme - le système péritectique
Dans ce cas, la température de fusion de l’eutectique vient s’insérer entre la température de fusion des deux composés A et B purs : le système est appelé péritectique (Fig. 11.15).
|
Exemples |
Ag-Sn |
Au-Sn |
In-Li |
W-Pt |
Re-Pt |
Cu-Zn |
Ti-W |
W-Pd |
W-Re |
AgNO3-NaNO3 |
|
|
Figure 11.15. Diagramme d’un mélange péritectique.
2.f Introduction des transformations allotropiques - études par rayons X
Un solide (s) cristallise par exemple à la température ordinaire dans un système particulier. À une autre température, il peut cristalliser dans un autre système cristallin. L’application de la règle de la variance montre que la température de transition est unique et déterminée par le système.
u = C + 1 - j = 1 + 1- 2 = 0
Exemple : Fe (a, magnétique) |
|
Fe (a, paramagnétique) |
Fe (a, paramagnétique) |
Fe (g) |
Dans le cas de solution solide, par exemple d’une solution a, solution d’un peu de B dans un solvant A, l’application de la règle des phases montre que la température de transition de phase dépend de la composition : elle varie avec la teneur en soluté.
u = C + 1 - j = 2 + 1 - 2 = 1
Les phases solides obtenues à diverses températures sont rapidement refroidies à la température ordinaire (trempe physique) pour éviter d’autres transformations. Ainsi "gelés" les échantillons sont analysés à l’aide des rayons X pour identifier les structures cristallines.
2.g Cinquième type de diagramme - miscibilité nulle en phase solide et partielle en phase liquide
Soit donc le diagramme apparaissant à la figure 11.16. On remarque que le diagramme est constitué d’un mélange présentant le phénomène de la cristallisation eutectique. L’une des branches du liquidus est cependant déformée. Une zone de démixtion du liquide en deux phases l' + l" apparaît.
|
|
Figure 11.16. Diagramme binaire isobare avec miscibilité partielle en phase liquide.
Soit un mélange représenté par le point L de composition xL. En le refroidissant, en D, apparaissent les premiers cristaux de A pur en équilibre avec le liquide. À la température correspondant au point M, le solide A est en équilibre avec le liquide de composition indiquée par la position du point N. Arrivé en E, le liquide de composition xG est saturé en B : il ne peut plus en dissoudre. Intervient alors la démixtion du liquide : une deuxième phase liquide de composition xH apparaît. Le système contient trois phases : il est invariant tant et aussi longtemps que le liquide de composition xG est présent. Lorsque cette phase a disparu, la température recommence à diminuer et atteint éventuellement la température de précipitation de l’eutectique.
Exemples |
eau-phénol |
Li-Na |
Bi-Zn |
Bi-Co |
Cr-Cu |
Cu-Pb |
eau-C6H5COOH |
Mg-Na |
Sn-S |
Sn-P |
Zn-Pb |
Ag-Cr |
2.h Formation de composés intermédiaires définis AmBn
Soit un système binaire A-B donnant lieu à la formation d’un composé intermédiaire de formule AmBn où m et n sont des nombres entiers. Selon la composition globale, on aura soit un excès de A soit un excès de B par rapport à la composition AmBn. Le diagramme total peut être considéré comme deux diagrammes juxtaposés : un diagramme A-AmBn et B-AmBn. On observera, par exemple, la formation de deux systèmes eutectiques ayant chacun leur propre température de fusion.
Il faut ajouter que le composé AmBn étant un corps pur, on s’attendrait à ce que le sommet des deux courbes de liquidus se terminant au point de fusion du composé intermédiaire soit anguleux. Or ce point est arrondi, avec tangente horizontale commune aux deux courbes. Cet arrondi indique qu’au point de fusion une partie des molécules AmBn se dissocie. Il s’établit un équilibre de la forme :
AmBn |
|
m A + n B |
On dit que le composé intermédiaire a un point de fusion congruent ou encore a un semitectique. Il existe par contre des cas où le composé intermédiaire se dissocie avant de parvenir à son point de fusion.
La figure 11.17 montre un cas où, en plus de deux transformations eutectiques, il y a formation de deux composés intermédiaires A2B et AB2. On peut voir que le composé A2B est stable jusqu’à la température de fusion. On dit que le composé A2B a une température de fusion congruente.
|
|
Figure 11.17. Formation de composés intermédiaires.
Il faut mentionner qu’en phase liquide le constituant A2B n’existe pas. À ce point de fusion, point M, ce composé se dissocie en ses éléments A et B. On montre alors que les courbes de liquidus en ce point de fusion congruente ont des tangentes horizontales.
Au contraire, l’intermédiaire AB2 se décompose avant d’atteindre la fusion. Parvenu à la température correspondant au point N, cet intermédiaire laisse place à la formation du liquide et du composé B pur. On dira que le solide AB2 a un point de fusion incongruente.
Exemples :
FeCl3-H2O : FeCl3,6H2O - FeCl3,3,5H2O - FeCl3,2,5H2O - FeCl3,2H2O (Fig. 11.18) |
|||
CuCl-FeCl3 : CuCl,FeCl3 |
Au-Te : AuTe2 |
Al-Se : Al2Se3 |
Fe-Be : FeBe2 |
CaCl2-KCl : CaCl2,KCl |
Au-Sn : AuSn |
Al-Fe : Al5Fe2 |
Mg-Zn : MgZn2 |
|
|
Figure 11.18. Diagramme approximatif eau-FeCl3.
Les systèmes constitués d’un mélange racémique d’une paire d’énantiomères peuvent être inclus dans ce groupe. Les deux énantiomères existent dans la maille cristalline du racémique dans un rapport 50/50 : le composé racémique est bien défini tout comme un composé intermédiaire. Les figures 11.19 montrent deux exemples typiques de tels diagrammes. Dans le premier cas, les deux composés énantiomères de l’acide tartrique, les acides L-(+) D-(-), ont des températures de fusion voisines de 169 ºC alors que le racémique fond vers 206 ºC (Fig. 11.18a). C'est aussi le cas du tartrate de diméthyle : Tfus(+) = Tfus(-) = 43,3 et TR : 86,4 ° C. Dans le second cas de figure, l’acétate de bornyle racémique fond vers +7 ºC alors que ses deux énantiomères fondent vers 26,5-27 ºC (Fig. 11.18b).
a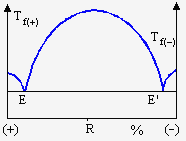 b
b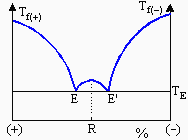
Figure 11.19. Exemples de diagrammes binaires de mélanges racémiques.
|
|
Figure 11.20. Diagramme or-étain.
Le diagramme binaire or - étain (Fig. 11.20) montre les points particuliers suivants :
- Au point A : une transformation péritectique à 650 ºC;
- Aux points B et F : deux transformations eutectiques à 290 et à 217 ºC;
- La formation de trois composés intermédiaires AuSn, AuSn2 et AuSn3;
- Un point de fusion congruent : fusion de l’intermédiaire AuSn vers 410 ºC;
- Deux points de fusion incongruents : AuSn2 à 309 ºC et AuSn3 à 257 ºC.
3. Études de quelques cas
3.a Les alliages à base de cuivre
Les laitons sont des alliages de cuivre et de zinc (Fig. 11.21). Ceux employés dans l’industrie sont aussi appelés cuivre jaune à cause de leur couleur. Les bronzes sont constitués de cuivre et d’étain avec parfois un peu de zinc. Ils sont préparés par fusion du cuivre (élément peu oxydable par l’air) dans lequel on ajoute le zinc ou l’étain. Les laitons possèdent les qualités essentielles du cuivre rouge mais ils sont plus malléables et plus ductiles. Leur dureté, leur résistance mécanique et leur résistance à l’oxydation sont plus grandes. Ils se moulent mieux et ils ne graissent pas la lime surtout lorsqu’ils sont additionnés d’un peu d’étain ou de plomb. Le tableau 11.2 précise l'usage de certains de ces alliages.
|
|
Figure 11.21. Les alliages cuivre - zinc.
Tableau 11.2. Composition typique des bronzes
Objets : |
Cuivre |
Étain |
Zinc |
Médailles |
90 - 96 |
10 - 4 |
- |
Monnaies |
95 |
4 |
1 |
Canons |
90 |
10 |
- |
Cloches |
80 |
20 |
- |
Statues |
80 - 85 |
6 - 7 |
8 - 14 |
Les bronzes, au contraire, sont peu malléables, peu ductiles sauf pour de faibles teneurs en étain. On les utilise surtout pour le moulage des cloches, des statues (Tableau 11.2). On les utilisait autrefois pour fabriquer les canons.
La dénomination bronze a été pour un temps étendue au bronze d’aluminium (90 % atomique en cuivre et 10 % en aluminium). Ce type d’alliage présente une résistance à la traction et un allongement équivalent à certains aciers en plus de posséder une belle teinte.
Le duralumin est un alliage d’aluminium contenant 3 % de cuivre et des traces d’autres métaux. Cet alliage a des propriétés mécaniques remarquables tout en gardant la légèreté de l’aluminium. Il ne faut pas confondre cet alliage avec un nouvel alliage appelé "duralcan" mis au point par la société ALCAN (maintenant Rio Tinto - Alcan) et contenant, outre l’aluminium, de la silice.
Les maillechorts ou argentans sont des laitons additionnés de nickel. Ils forment des métaux blancs, durs, peu oxydables, intéressants à cause de leur teinte. Comme ils ont une faible conductibilité électrique, on les utilise pour la fabrication de résistances électriques. On les utilise aussi pour fabriquer des couverts que l’on argente ensuite.
3.b Application au déglaçage des voies carrossables
Le choix d’un sel pour le déglaçage des rues en hiver doit obéir à un certain nombre de propriétés.
a- Il doit bien sûr être exempt de propriétés adverses sur l’environnement. Cela élimine de nombreux sels comme les iodures, bromures, cyanures, ... les acides, les bases, ...
b- L’abaissement cryoscopique (voir Chapitre IX.5.b) doit être le plus prononcé possible. Selon la loi de RAOULT, l’abaissement est proportionnel à la concentration du soluté. De préférence, il faut donc prendre un composé qui se dissocie en plusieurs ions (effet du nombre d’espèces).
c- La propriété physique déterminante réside dans le fait que le plateau de fusion de l’eutectique soit le plus favorable possible.
Exemples :
| Teu(IK) = - 23 ºC | Teu(Na2SO4) = - 1,3 ºC | Teu(CaCl2) = - 30 ºC |
| Teu(H2SO4) = - 75 ºC | Teu(NaCl) = - 23 ºC | Teu(FeCl3) = - 55 ºC |
d- Enfin, il faut que le coût du produit retenu soit le plus abordable possible.
Le compromis le plus simple conduit à l’utilisation du sel commun NaCl.
3.c Le diagramme Fe-C - fabrication des aciers
La fabrication des aciers est à l’évidence d’importance économique indiscutable. La connaissance du diagramme de base fer - carbone est donc pertinente (Fig. 11.22). L’addition de quelques pour cents de carbone modifie profondément les propriétés du fer.
|
|
Figure 11.22. Diagramme fer - carbone : le % est exprimé en poids.
La métallurgie du fer est tributaire de différents minerais, oxydes de fer, que sont :
- La magnétite, Fe3O4. C’est le meilleur minerai et comme il est relativement abondant, il a progressivement déclassé la plupart des autres minerais. Certains échantillons de magnétite forment des aimants naturels.
- Le sesquioxyde de fer, Fe2O3, encore appelé l’hématite rouge;
- L’oxyde ferrique hydraté, 2 Fe2O3, 3 H2O, encore appelé l’hématite brune;
- La sidérose, FeCO3, minerai à peu près maintenant ignoré;
- L’ilménite, FeTiO3 que l’on trouve sur la Côte-Nord du Québec, ...
Le Haut-fourneau : la réduction de l’oxyde de fer
Le haut-fourneau est une construction verticale en briques réfractaires d’environ 30 m de hauteur et 5 m de diamètre capable de produire 1000 tonnes de fonte en 24 heures (Fig. 11.23). Ce four est une version chimique du procédé à contre-courant. Des gaz chauds (l’élément réducteur, le CO) ont un mouvement ascendant alors que les matières solides (l’élément à réduire, l’oxyde de fer) puis liquides effectuent un mouvement descendant.
|
|
Figure 11.23. Le haut fourneau.
On introduit en haut de cette tour, par le gueulard, de manière alternative le charbon (du coke), le minerai de fer et un fondant de la pierre à chaux. Par des tuyères situées à la base on introduit de l’air préalablement chauffé à 800 ºC. Certaines installations utilisent de l’oxygène plutôt que de l’air.
L’air rencontre le carbone. La réaction exothermique élève la température du milieu à 1800 ºC. La majeure partie du gaz carbonique est réduit par le carbone et forme le monoxyde de carbone. L’oxyde de fer est alors réduit. Poursuivant sa descente, le fer fond et absorbe jusqu’à 4 % de carbone pour donner la fonte. Les impuretés du minerai, et principalement la silice, réagissent avec la chaux vive libérée par la pierre à chaux. Il se forme un liquide que l’on appelle le laitier. Les deux liquides se séparent par différence de densité, la fonte plus lourde, densité de 8 est surmontée du laitier de densité 3.
Les réactions sont :
phase 1, formation de l’agent réducteur :
C(coke) + O2 (air à 800 ºC) ® CO2 + chaleur, réaction suivie de CO2 + C(coke) ® 2 CO
phase 2, réduction du minerai et la formation de la fonte :
Fe3O4 + 4 CO ® 3 Fe (¯ ) + 4 CO2 ( g )
Fe(s) ® Fe(l) et Fe(l) + C ® [Fe, Fe3C](l)
phase 3, élimination de la silice :
CaCO3 + chaleur ® CaO + CO2 ( g ), réaction suivie de CaO + SiO2 ® CaSiO3
En complément, le laitier est utilisé comme engrais de qualité moyenne à faible. Par ailleurs les gaz chauds qui sortent du haut fourneau sont récupérés. Ils servent à chauffer des tours principalement constituées de briques réfractaires. Ces gaz contiennent encore du monoxyde de carbone qui y est brûlé augmentant la température de la tour de briques jusqu’à des températures de l’ordre de 1500 ºC. On utilise alors cette tour pour préchauffer l’air de l’alimentation du haut fourneau à 800 ºC pendant que l’on chauffe une autre tour et ainsi de suite.
Tous ces minerais contiennent un peu de silice et le résultat est une fonte qui contient de 2 à 5% de carbone, un peu de silicium, des traces de soufre et de phosphore, ... La quantité de silicium dépend de la température du haut fourneau. En allure chaude, c’est-à-dire avec un excès de charbon, la quantité de silicium peut atteindre 2 %. Le silicium libéré par la réduction se combine au fer et chasse le carbone. On obtient des fontes grises. Avec moins de carbone, en allure froide, la faible quantité de carbone reste combinée au fer. On obtient des fontes blanches.
Pour obtenir 1 kt de fonte, il faut 4 kt d’air, 2 kt de minerai, 1 kt de coke et 0,5 kt de fondant. Bien entendu, la qualité (pureté) du minerai introduit des modifications. Plus le minerai est pur, et moins on aura besoin de fondant. Il existe des minerais très purs (Sibérie, Mauritanie) qui malgré l’éloignement des aciéries, sont très compétitifs : ils ont éliminé des minerais plus pauvres autrefois utilisés. Alors qu’au milieu du siècle dernier, en France, les aciéries étaient situées sur les gîtes miniers (par exemple, en Lorraine), on les trouve souvent maintenant près des ports (Dunkerque).
Dans les deux cas, la fonte obtenue est cassante et peu malléable. Il faut éliminer le silicium et les traces de soufre et de phosphore. Ces éléments étant plus oxydables que le fer, on peut procéder à leur oxydation. Au moins deux procédés ont été développés. On oxyde le milieu directement à l’air (procédé BESSEMER) ou en ajoutant de l’hématite (procédé MARTIN). Le premier procédé ne demande pas d’ajout d’énergie : l’oxydation des impuretés apporte l’augmentation de température nécessaire. Le second procédé demande un chauffage d’appoint. Par contre, il permet un dosage plus fin des mélanges métalliques que l’on souhaite incorporer à l’acier. En fin d’oxydation, on peut ajouter du carbone pour obtenir l’acier désiré. On obtient ainsi des aciers contenant de 0,2 à 1 % de carbone. Alors que la résistance à la traction du fer est d’environ 30 kg/mm2, celle de l’acier à 0,1 % peut atteindre 80 kg/mm2. Au-delà de 1 % de carbone les aciers deviennent cassants.
Dépendant de la concentration de carbone et de la température de formation, on trouvera différentes variétés cristallines. Le fer a (ferrite) et d sont cubiques centrés : ils ne dissolvent que de faibles quantités de carbone : moins de 0,1 % (Fig. 11.22). Le fer g (austénite) est cubique à faces centrées. Cette structure dissout jusqu’à 1,6 % de carbone. Il existe un composé intermédiaire appelé la cémentite et de formule Fe3C. Le fer b n’existe pas. En fait, on a déjà considéré que le fer a existait jusqu’à 210 ºC et que le fer b existait entre 210 et 910 ºC. La transition à 210 ºC correspond seulement à une transformation magnétique sans modification de structure cristalline. On observe également la formation de deux eutectiques : la ledeburite formée de fer g et de cémentite et la perlite formée de ferrite et de cémentite. La perlite présente une structure microscopique particulière (Fig. 11.24). La structure cristalline mais aussi l’enchevêtrement des cristaux ont une influence déterminante sur les propriétés physiques des aciers.
|
|
Figure 11.24. La perlite.
L’utilisation de la trempe physique permet de maintenir à la température ordinaire des structures thermodynamiquement stables seulement à haute température, multipliant ainsi les variétés et les propriétés des aciers.
|
4. Conclusions Dans le cas de mélanges solides de type binaire, on observe des systèmes où les constituants sont complètement miscibles et d’autres sont totalement non miscibles avec entre ces deux extrêmes toute une gamme de solubilité partielle. La solubilité réciproque des constituants est fortement dépendante du diamètre et de la similarité du réseau cristallin des atomes ou des molécules constitutifs. Dans le cas de mélanges de deux solides de diamètres semblables, les diagrammes solide - solide observés ressemblent à ceux des mélanges de deux liquides complètement miscibles. Les courbes de solidus et de liquidus s’apparentent dans ces cas au fuseau de distillation. Pour les mélanges plus difficilement miscibles on observe des diagrammes de plus en plus déformés au fur et à mesure de la décroissance de la miscibilité. Apparaissent ainsi les diagrammes eutectiques et péritectiques. Par ailleurs des particularités viennent compliquer l’allure des diagrammes. Certains mélanges binaires A – B forment des composés intermédiaires qui forment autant de diagrammes binaires supplémentaires. En résumé, chaque mélange binaire est un cas particulier. Les utilisations des mélanges binaires sont nombreuses et variées. L’épandage de sel sur la chaussée verglacée, la fabrication d’alliages aux propriétés très particulières, la fabrication de l’acier, … sont autant d’exemples typiques. |
5.1. Indiquer, dans l’ordre donné, si les énoncés qui suivent sont vrais ou faux.
a. Étant donné un système constitué seulement de phases liquides à température et pression données, le nombre maximum de phases en équilibre ne peut dépasser le nombre de constituants indépendants.
b. Si l’on varie la composition d’un système ternaire à température constante, les segments conjugués entre deux phases données sont en général parallèles les uns aux autres.
c. Pour définir un système ternaire constitué de deux phases condensées, il suffit d’indiquer la température et la fraction molaire de l’un des constituants.
d. Si la courbe de refroidissement d’un mélange de deux constituants organiques en fusion ne démontre pas de palier de température constante, ces deux constituants forment des solutions solides.
e. Dans un diagramme ternaire isotherme, si l’on relie par une droite un des cotés du triangle au sommet opposé, la droite tracée représente les mélanges pour lesquels deux des constituants sont dans un rapport de masse constant.
5.2. Donner l’allure générale du diagramme d’équilibre des phases d’un système binaire à deux composants A et B ayant les propriétés suivantes :
- point de fusion de A 142 ºC;
- point de fusion de B 185 ºC;
- point de fusion de A3B 110 ºC;
- point eutectique de A et de A3B 101 ºC;
- point eutectique de B et de A3B 85 ºC.
Indiquer pour chaque région du diagramme de phase les équilibres en présences.
5.3. Tracer l’allure générale du diagramme de phase du système thallium - mercure à partir des données qui suivent et indiquer pour chaque région les phases en équilibre.
- Tfus(Tl) = 303 ºC, Tfus(Hg) =
-
39 ºC et Tfus(Tl2Hg5) = 15 ºC.
- Les masses moléculaires sont : thallium : 204,4 et mercure : 200,6.
- Le thallium ne forme pas de solution solide avec le mercure.
- Le thallium forme avec Tl2Hg5
un eutectique de composition 41 % en Tl, lequel eutectique se solidifie à 0,4 ºC.
- Le thallium abaisse le point de fusion du mercure
jusqu’à un minimum
de -
60 ºC à 8 % de Tl.
5.4. Le phénol fond à 40 ºC et la a-naphtylamine fond à 50 ºC. Dans le système binaire, il se forme deux eutectiques : le premier, A, fond à 17 ºC et contient 75 % de phénol ; le second, B, fond à 23 ºC et contient 36 % de phénol. Un composé intermédiaire contenant 50 % de phénol est stable et fond à 28 ºC.
1- Tracer le diagramme en expliquant chacune des régions.
2- Tracer le profil des courbes de refroidissement entre 50 et 10 ºC pour les mélanges contenant 40, 50, 60 et 85 % de phénol. On admettra que les deux composés phénol et a-naphtylamine sont insolubles l’un dans l’autre.
5.5. Le diagramme de phase aluminium - calcium contient les éléments suivants :
Tfus(Al) = 650 ºC et Tfus(Ca) = 800 ºC.
Composés intermédiaires : Al2Ca, Tfus (congruente) = 1050 ºC
Al3Ca, Tfus (incongruente) = 700 ºC
Aucun des produits chimiques impliqués n’est soluble dans un autre à l’état solide.
Le mélange Al-Al3Ca produit un eutectique dont la température de fusion est voisine de 610 ºC.
Le mélange Ca-Al2Ca produit un eutectique dont la température de fusion est voisine de 540 ºC.
Dessinez le diagramme de phase Al-Ca.
5.6 À 1600 ºC, les solutions liquides du MnO dans FeO et de manganèse dans le fer peuvent être considérées comme idéales. Déterminer la concentration, exprimée en %, de masse de manganèse dans le fer en équilibre avec le mélange de scories (solution solide de MnO dans FeO) dans lesquelles la fraction molaire de MnO est 0,30 et celle de FeO de 0,70 toujours à 1600 ºC. On sait par ailleurs que :
[1] Fe (l) + 1/2 O2 (g) |
FeO (l); DGº = - 232 490 + 45,27 T J·mol-1 ; | |
[2] Mn (l) + 1/2 O2 (g) |
MnO (l); DGº = - 354 050 + 60,61 T J·mol-1 ; |
La température T est exprimée en K
Nota : Dans les procédés BESSEMER-THOMAS et MARTIN-SIEMENS, l’affinage de l’acier par le manganèse se fait en ajoutant une fonte au manganèse appelée "spiegel". Le but évident recherché est la réduction de l’oxyde de fer par le manganèse selon la réaction :
[3] FeO (l) + Mn (l) |
MnO (l) + Fe (l); DGº = ? |
Réponse : 1,08 % de Mn dans le fer
5.7.
Compléter le diagramme binaire
suivant en
a- Indiquant les points intéressants
ou particuliers et en
b- Traçant les lignes qui manquent et
indiquer toutes les phases présentes.
|
|
5.8. Action du carbone sur les oxydes de fer
La variation de l’énergie libre de la réaction de BOUDOUARD est donnée par
DG = 170 544 - 174,31 joules
| La réaction de BOUDOUARD est : | [1] C (s) + CO2 (g) ® 2 CO (g) |
1. Établissez la valeur de KP entre 600 et 1300 K par valeur de 100 K
2. Calculez la valeur de KP,T à chaque valeur de T.
3. En supposant que la pression du gaz est de une (1) atmosphère et que celle-ci est composée d’azote (0,5 atmosphères), de CO et de CO2, calculez la composition de la phase gazeuse sous la forme des pressions partielles.
4. Tracer le rapport
![]()
Conclure sur l’équilibre de BOUDOUARD.
5. On se propose d’étudier les équilibres entre les oxydes de fer et le fer. On sait que :
[2] Fe + 1/2 O2 ![]() FeO ;
FeO ;
[3] 3/4 Fe + 1/2 O2 ![]() 1/4 Fe3O4 ; DG°[3] =
- 272 540 + 78,12 T
joules
1/4 Fe3O4 ; DG°[3] =
- 272 540 + 78,12 T
joules
[4] 2/3 Fe + 1/2 O2 ![]() 1/3 Fe2O3 ; DG°[4] =
- 270 030 + 85,06 T
joules
1/3 Fe2O3 ; DG°[4] =
- 270 030 + 85,06 T
joules
Que pouvez-vous dire des équilibres suivants :
[5] 3 FeO + 1/2 O2 ![]() Fe3O4 ;
Fe3O4 ;
[6] 4 FeO + 1/2 O2 ![]() Fe + Fe3O4 ;
Fe + Fe3O4 ;
[7] 3 FeO ![]() Fe + Fe2O3 ?
Fe + Fe2O3 ?
6. Indiquer dans quel domaine de température l’équilibre
[8] 1/4 Fe3O4 + CO ![]() 3/4 Fe + CO2
3/4 Fe + CO2
est important. Discutez de la métallurgie du fer dans ces conditions. On indique que pour
[9] CO + 1/2 O2 ![]() CO2 ;
CO2 ;
7. En fait on montre que les équilibres entre les différents oxydes de fer et les gaz CO et CO2 sont donnés dans la figure ci-dessous. Expliquer la métallurgie du fer en comparant sur le même graphe les zones des équilibres des oxydes FeO, Fe2O3, Fe3O4, CO, CO2 et Fe.
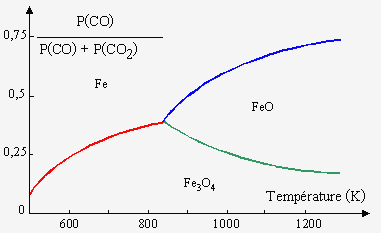 |
Pour en savoir beaucoup plus :
Findlay A., The Phase Rule, 9e édition, revue par Campbell A. N. et Smith N. O., Dover, New York (1951).On trouvera un grand nombre de diagrammes binaires également sur le net.
Plus intéressant peut-être un site présentant en anglais un tutoriel accompagné de quiz sur la construction, les propriétés et les usages des diagrammes de phase : http://www.soton.ac.uk/~pasr1/
Un prix Nobel :
NÉEL : http://nobelprizes.com/nobel/physics/1970b.html
On trouvera aussi
un grand nombre de
diagrammes binaires
également sur le net.
« Les matériaux carbonés : recherche et applications », L'actualité chimique (Société chimique de France), N° 295-296, mars-avril 2006.
Dernière mise à jour : 2021-07-08.
x x x x x x x x x x x x x x