|
|
LES RAYONS X
|
Toutes les propriétés du nuage électronique étudiées jusqu’ici concernaient exclusivement les électrons périphériques de l’atome. Question :
Objectif :
|
Découverts en 1895 par RŒNTGEN, ces rayons ne sont déviés ni par un champ électrique ni par un champ magnétique. Ils ne sont donc pas constitués de particules chargées. Ont peut aussi montrer qu’ils n’ont pas de masse. Ils occupent une partie de l’échelle des fréquences électromagnétiques dont les limites sont arbitrairement fixées entre 0,05 et 1,0 nm (1,5 ´ 1012 et 3 ´ 1011 MHz/s). On sait que l’on peut produire de tels rayons par bombardement d’un métal (anticathode) avec des électrons rapides. On peut les détecter par la fluorescence qu’ils excitent ou par l’ionisation qu’ils produisent dans une chambre d’ionisation.
La spectrographie des rayons X; est tout à fait analogue à la spectrographie de la lumière visible et ultraviolette par les réseaux de diffraction. La longueur d’onde très courte des rayons X nécessite l’emploi de réseaux dont les traits sont très serrés. Il est possible de construire de tels réseaux et des expériences ont pu être faites, qui ont conduit à la mesure absolue de la longueur d’onde des rayons X. Cette valeur absolue est tirée directement de la formule fondamentale des réseaux :
d ( sin i' - sin i ) = k l
Dans cette expression, d = intervalle du réseau; i = angle d’incidence; i' = angle de diffraction; k est un nombre entier; et l est la longueur d’onde. Puisque d est connu par construction du réseau, que i et i' peuvent être mesurés ainsi que k, l peut être connu en valeur absolue. Cette mesure est extrêmement délicate car l’obtention d’un spectre de rayons X à partir d’un réseau de diffraction est très difficile. Il faut en effet que la périodicité du cristal soit de l’ordre de grandeur du rayonnement à mesurer. On arrive à construire des réseaux aussi fins que 10 nm. Il faut travailler en incidence rasante pour que le rayonnement le voit comme étant constitué de raies séparées de 0,1 nm. Par contre, les réseaux naturels formés par les cristaux sont d’utilisation plus facile. La formule de BRAGG (Chapitre 3.5) donne la relation entre la longueur d’onde et l’intervalle des plans réticulaires du cristal (voir formule 3.11) :
2 d sin q = n l |
Si on connaît d, on peut mesurer q et connaître l. La valeur de d a été déterminée avec une grande précision pour un certain nombre de cristaux simples (comme ceux cristallisant dans le système cubique à faces centrées, exemple : NaCl). Ce sont ces cristaux qui servent maintenant à obtenir des spectres de rayons X de longueur d’onde précise. Le nombre entier positif n est l’ordre de la diffraction. Connaissant la longueur d’onde du rayonnement X diffractant sur un cristal, et en mesurant les valeurs des angles de diffraction, on saura mesurer les distances des plans de diffraction.
|
|
Tube de CROOKES
|
|
Tube de COOLIDGE
Figure 11.1. Production du rayonnement X.
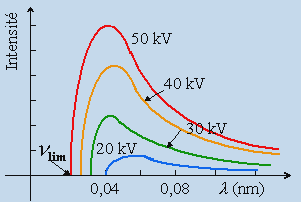
2. Le spectre continu des rayons X
Deux parties distinctes mais superposées dans le domaine des fréquences composent le spectre d’un élément : le spectre continu et le spectre de raies. Le spectre continu est indépendant de l’élément composant l’anticathode. Le spectre de raies est, au contraire, caractéristique de cet élément. Seul ce dernier est donc intéressant en ce qui concerne les niveaux d’énergie de l’atome. Cependant, le spectre continu apporte aux hypothèses quantiques de la lumière une confirmation non négligeable et c’est pour cette raison qu’il mérite un peu d’attention. Le spectre continu du tungstène par exemple dépend de la tension d’accélération des électrons, donc de l’énergie des électrons incidents. Chaque spectre présente une limite brutale du côté des grandes fréquences. La position de cette limite dans l’échelle des fréquences varie avec la tension appliquée aux électrons suivant la loi :
| 11.1 | h n lim = e V |
 |
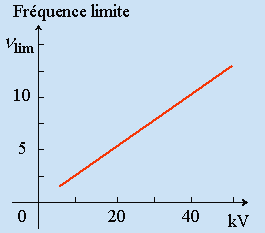 |
| A: Spectre continu du tungstène. | B: Fréquence limite : nlim = f(V). |
Figures 11.2. Propriétés de l’émission des rayons X (spectre continu).
La ressemblance entre cette équation et celle traduisant l’effet photoélectrique (Chapitre IV.5) a suggéré l’explication du phénomène. Alors que dans l’effet photoélectrique, l’énergie du quantum incident hn était transformée en énergie cinétique, le mécanisme qui prévaut ici est inversé: l’énergie cinétique de l’électron incident est transformée en énergie électromagnétique. Puisque le spectre émis est continu, il faut penser que tous les électrons qui ont une énergie eV transforment leur énergie cinétique au hasard des collisions, par étapes successives. Ces étapes peuvent être assimilées à des freinages successifs subis par l’électron lorsqu’il rencontre les atomes de l’anticathode. La fréquence limite que l’on peut obtenir par ce procédé correspond à la perte de la totalité de l’énergie de l’électron par arrêt brutal. L’équation 11.1 exprime cette éventualité. Il faut ajouter que cette équation fournit la base d’une excellente mesure de la constante h. Redisons que la valeur limite de la longueur d’onde est indépendante de la nature de l’élément émetteur: elle ne dépend que de l’énergie des électrons incidents. La valeur nlim est appelée la limite de DUANE-HUNT.
3. Interprétation du spectre d'émission discontinu
Au fur et à mesure que l’on augmente la tension accélératrice, V, des électrons incidents, le spectre continu se déplace vers les courtes longueurs d’onde (les hautes fréquences) et son intensité augmente. À certaines valeurs de la tension accélératrice, V0, il apparaît un spectre de raies appelé le spectre caractéristique. Ces raies sont en effet caractéristiques du métal bombardé et émetteur du rayonnement X. Ces raies que l’on appellera Ka, Kb, … sont fixes (en longueur d’onde) et ont une intensité qui augmente rapidement avec la tension accélératrice des électrons. Ces raies caractéristiques sont utilisées en cristallographie. Puisque les deux spectres continu et caractéristique apparaissent concurremment, il est important d’établir les conditions expérimentales pour maximiser le rapport intensité de la raie caractéristique sur l’intensité du spectre continu. On montre que ce rapport est maximum pour un rapport V/V0 de l’ordre de 3 à 5.
|
|
Figure 11.3. Spectre continu de rayons X du tungstène (W) et spectre caractéristique du molybdène (Mo) obtenus avec la même tension accélératrice des électrons.
Les spectres de raies X sont beaucoup plus simples que les spectres optiques. Pour tous les éléments, des groupes de raies sont observés, ces groupes étant nettement séparés les uns des autres. Ils ont reçu les noms : groupes K, L, M, etc. Chaque groupe comporte une série de raies (Ka, Kb, etc.) qui se rapprochent de plus en plus jusqu’à une fréquence limite. Ces groupes apparaissent successivement dans l’ordre inverse du précédent lorsque la tension accélératrice des électrons est augmentée progressivement. Le groupe K a la fréquence la plus grande.
MOSELEY, physicien anglais, montra en 1913 que l’on pouvait représenter la fréquence des raies homologues pour chacun des éléments par une formule du type :
| 11.2 | n = a ( Z - s )2 |
Dans cette égalité, a et s sont des constantes et Z le numéro atomique. Par exemple, pour les éléments allant de Z = 20 à 30, on trouve pour les raies K la relation :
| 11.3 | n = 0,764 RH c (Z - 1,13)2 |
Dans cette formule, RH est la constante de RYDBERG et c la vitesse de la lumière. On peut interpréter grossièrement cette formule à l’aide de la théorie de BOHR relative à l’atome d’hydrogène, si on admet que l’électron incident chasse un électron de l’atome placé sur la couche n = 1 (couche K). Un électron placé sur la couche n = 2 vient le remplacer, libérant l’énergie sous forme d’une fréquence électromagnétique Ka :
![]()
| 11.4 | n2,1 = 0,75 c RH Z 2 |
Ce calcul est évidemment très grossier car il suppose que dans un atome quelconque, la présence des autres électrons ne modifie pas la valeur des niveaux d’énergie. L’agrément avec la formule expérimentale de MOSELEY est cependant bon, surtout si l’on pense que pour les valeurs élevées de Z, (Z - 1,13) et Z ne sont pas très différents.
La quantité s peut d’ailleurs être interprétée. Tout se passe comme si on pouvait appliquer le calcul de BOHR des niveaux d’énergie à tous les atomes mais en diminuant la charge réelle du noyau Z d’une quantité fictive s. Cette valeur de s donne une idée de l’effet écran exercé par la présence des autres électrons intercalés entre le noyau et l’électron qui effectue la transition. Cet effet écran est très petit pour la transition Ka; il augmente pour les autres couches et la valeur s est de 7,4 pour la raie La et pour la série des éléments compris entre Z = 40 et Z = 79. Cette valeur numérique de 7,4 doit être comparée avec le total des électrons contenus dans les couches K et L (2 + 8) confirmant ainsi cet effet écran vue de la couche n = 3.
|
|
Figure 11.4. Loi de MOOSELEY.
Si, au lieu de comparer les raies Ka des divers éléments, on cherche à retrouver la totalité des raies K d’un seul élément Ka , Kb , . . . l’application de la formule de BOHR, en tenant compte de l’effet d’écran, interprète les résultats expérimentaux. On obtient une série de raies résultant des transitions :
n = 2 ® n = 1; n = 3 ® n = 1, . . . etc. ; n = ¥ ® n = 1.
Cette dernière transition fixe la limite de la série K. Le même raisonnement peut être fait pour le niveau final n = 2 (série L) etc.
On peut connaître de façon simple l’intensité d’un faisceau de rayons X à l’aide d’une chambre d’ionisation (voir le chapitre XV). On mesure au moyen d’un électroscope la quantité d’électricité produite par les ions créés dans la chambre par le passage du photon X. Par interposition de divers matériaux sur le chemin du faisceau, cet instrument peut également servir à mesurer le pouvoir absorbant de ces substances.
|
|
Figures 11.5. Coefficient d’absorption des rayons X.
Si Io est l’intensité incidente et I l’intensité transmise, on trouve que les rayons X suivent la loi habituelle d’absorption des rayons lumineux en fonction de l’épaisseur d de la matière absorbante (loi de BEER-LAMBERT ) :
| 11.5 | Io = e-m d |
µ est un coefficient d’absorption caractéristique du matériel absorbant et de la longueur d’onde utilisée. Ce coefficient est approximativement proportionnel au cube de la longueur d’onde. Entre les discontinuités dont on parlera ci-dessous, le coefficient d’absorption des rayons X est donné par la loi de BRAGG-PIERCE : µ = k Z4 l3 où Z est le numéro atomique, l la longueur d’onde et k un facteur de proportionnalité. La formule 11.5 n’est valable que si le mécanisme d’absorption reste le même, identique à celui de la lumière visible. Les rayons X peuvent être absorbés par un mécanisme différent en raison de l’énergie élevée de leurs photons. Cette énergie est suffisante pour chasser les électrons des couches de l’élément absorbant et on observe à ce moment une augmentation brutale de l’absorption (Fig. 11.5). La courbe représentant µ en fonction de la longueur d’onde l présente donc une discontinuité chaque fois que la valeur hn correspond à l’énergie d’un électron du matériel absorbant. On observe ainsi des discontinuités pour les couches K, L, M, etc. La fréquence des discontinuités correspond à la fréquence de la limite des séries. En effet, les couches supérieures de l’atome étant remplies, l’électron doit être complètement éjecté de l’atome pour satisfaire au principe d’exclusion de PAULI.
5. Interprétations des détails dans la structure des spectres
Nous avons vu que pour chaque valeur du nombre quantique principal n, on avait un certain nombre d’orbites possibles dépendant de s et de j et correspondant à des niveaux d’énergie différents. On a aussi des orbites correspondants aux différentes valeurs de m, mais comme elles sont dégénérées, elles ne sont pas pertinentes à cette discussion. Pour calculer j, il faut donc considérer la couche d’arrivée d’un électron plus externe. Toutes les couches sous-jacentes, plus profondes, sont saturées : leur contribution au moment magnétique est nulle. La couche qui contient une vacance a nécessairement un électron non apparié : son spin s = ± 1/2. La valeur de j est telle que j = l ± 1/2. Le tableau suivant résume les nombres quantiques pour les orbites d’énergie différente.
Tableau 11.1. Nombres quantiques pour orbitales différentes
| Couche n | l | s | j | |
| K | 1 | 0 | 1/2 | 1/2 |
| L | 2 | 0 1 1 |
1/2 - 1/2 + 1/2 |
1/2 1/2 3/2 |
| M | 3 | 0 1 1 2 2 |
1/2 - 1/2 + 1/2 - 1/2 + 1/2 |
1/2 1/2 3/2 3/2 5/2 |
Si ce schéma est correct, les raies correspondant à une transition entre deux couches ne peuvent être simples. C’est ce qui est observé. Il faut, dans l’interprétation des spectres, tenir compte des règles de sélection pour trouver le nombre exact de raies observées expérimentalement. Ces règles sont :
Dl = ± 1 et D j = 0, ± 1.
|
|
Figure 11.6. Transitions schématiques des raies X.
|
|
Figure 11.7. Explication graphique du détail des raies X.
(Note : l’espacement des niveaux d’énergie 2s, 2P1/2, 2P3/2 est très agrandi par rapport à la différence d’énergie des niveaux K, L,...).
Toutes les raies K sont doubles. On observe pour les raies L sept composantes groupées en trois groupes LI, LII et LIII suivant les trois niveaux inférieurs possibles. Les fréquences de ces trois séries sont suffisamment différentes pour qu’elles apparaissent comme des séries bien séparées. Le spectre d’absorption en particulier montre l’existence des discontinuités LI, LII et LIII. On trouve de la même façon cinq discontinuités M, etc. Signalons que l’on peut faire apparaître successivement en émission les raies LI, LII et LIII en augmentant progressivement la tension accélératrice des électrons qui bombardent l’anticathode. Le groupe LIII apparaît le premier, puis le groupe LII, puis LI. Il en est de même pour les autres groupes M, N, etc.
Les spectres d’émission et d’absorption des rayons X apportent donc une confirmation excellente des conceptions modernes sur la constitution de l’atome.
6. Les électrons AUGER
Lors des processus de formation des rayons X, il arrive que ceux-ci ne "sortent" pas tous du nuage atomique où ls sont générés. En effet, ils ont la possibilité, par effet COMPTON, d’expulser un électron plus périphérique, donc moins énergétique. Ces électrons expulsés de la phase solide sont appelés les électrons AUGER. L’énergie de ces électrons est est caractéristique du métal étudié. Ils sont donc analysés et servent à caractériser la composition du métal, et plus spécifiquement de leur surface.
Rappelons en effet, le processus de formation. Un faisceau d’électrons incidents est accéléré sous une tension de plusieurs dizaines de milliers d’eV. Leur pouvoir de pénétration dans le métal est inférieur à 1 µm. Ils expulsent des électrons des couches profondes des nuages atomiques. Les cavités positives ainsi crées sont rapidement comblées par des électrons plus extérieurs des nuages électroniques. Dans leur saut, ces électrons perdent l’énergie correspondante à la transition sous la forme d’un photon X. C’est ce photon X qui a fait l’objet des paragraphes précédents. Il a cependant une probabilité non nulle d’expulser un électron éloigné du noyau. C’est ce dernier qui constitue l’électron AUGER.
|
|
Figure 11.8. Production d’électron AUGER.
|
|
Figure 11.9. Comparaison simplifiée de la production d’un photon X et d’un électron AUGER.
Doués d’un pouvoir de pénétration très grand, les rayons X sont capables d’interférer avec n’importe quel électron du nuage électronique de l’atome. Il peut en particulier déloger ces électrons et les éjecter hors du nuage électronique, créant ainsi une cavité en quelle que sorte positive au sein de ce nuage. Ces cavités sont rapidement comblées par des électrons plus externes. En effectuant le saut électronique ces électrons perdent une partie de leur énergie sous la forme d’émission de lumière (photon). L’analyse des spectres d’émission ainsi générés permet de retrouver les familles de raies déjà observées lors de l’étude de l’atome de BOHR, ainsi que les règles de sélection qui gouvernent les transitions. Cas particulier : certains photons X ne s’échappent pas du nuage atomique. Ils ont en effet la possibilité d’expulser des électrons moins énergétiques. Ce sont les électrons AUGER très utiles dans l’analyse des surfaces métalliques.
|
| 7.1 | Une source de rayons X est produite en accélérant des électrons par une différence de potentiel de 45 000 volts. Quelle sera la longueur d’onde limite en nm du rayonnement X émis ? |
Réponse : l = 0,0275 nm.
| 7.2 | En utilisant une formule approximative, calculer la longueur d’onde du rayonnement X (raie Ka) émis par le zinc. |
Réponse : l = 0,135 nm.
| 7.3 | En utilisant la loi de MOSELEY, calculer l’énergie en keV et la longueur d’onde en nm de la raie Ka de l’or 79Au. |
Réponse : E = 63,0 keV.
| 7.4 | La réfraction de premier ordre d’un faisceau de rayons X sur un cristal apparaît à un angle de 5°15'. À quels angles apparaîtront les réfractions d’ordre 2 et 3 ? |
| 7.5 | La raie Ka du palladium est située à 58,6 picomètres. Quel est le voltage minimum que l’on doit appliquer sur les électrons pour produire ces rayons X ? |
Réponse : 21,6 kV.
| 7.6 | Un faisceau d’électrons monocinétiques est réfléchi sur un monocristal. Le plus petit angle de réflexion est de 54º. Si les plans réticulaires atomiques sont espacés de 0,215 nm quelle est la longueur d’onde associée au faisceau d’électrons ? |
Réponse : l = 0,3479 nm.
- - - - - - - - - - - - - -
Pour en savoir un peu plus :
L’histoire du tube à rayons cathodiques, Crookes, Coolidge, Moseley, ... voir Wikipedia.
Également, à lire un excellent résumé en français des principes et applications de la diffraction des rayons X : L'actualité chimique, N° 346, pages 24-28, novembre 2010.
Mooseley: http://hyperphysics.phy-astr.gsu.edu/hbase/quantum/moseley.html (visité le 2019-02-19)
https://www3.nd.edu/~nsl/Lectures/Laboratory/05_X-Ray-Spec.pdf (visité le 2019-02-19)
Et des prix Nobel :
RŒNTGEN : https://www.nobelprize.org/prizes/physics/1901/rontgen/biographical/ (visité le 2019-02-19)
Une animation sur le tube de Crookes : https://www.edumedia-sciences.com/fr/media/91-tube-de-crookes (visité le 2019-02-19)
Dernière mise à jour : 2021-07-26.
XXXXXXXXXXXXX