|
|
CHAPITRE 6
LA PHOTOCHIMIE ATMOSPHÉRIQUE
|
Objectifs Maintenant que les réactions engendrées par la lumière sont bien connues, appliquons-en les résultats à l’atmosphère terrestre. Questions :
|
Objectifs spécifiques
- Appliquer les lois de la photochimie et de la cinétique à la compréhension de la dynamique de l’atmosphère terrestre.
- Comprendre les mécanismes réactionnels des différents constituants de l’atmosphère : cycle du carbone, de l’azote, du soufre, ...
- Comprendre les conséquences des interventions et des activités humaines sur l’atmosphère.
- Comprendre les mécanismes aéronomiques des atmosphères des planètes du système solaire.
1. Introduction
Le chapitre précédent a traité de l’activation photochimique des réactions. L’énergie nécessaire au bon déroulement de la réaction chimique est apportée au système par un flux photonique. Un domaine privilégié de l’interaction lumière-matière est tout naturellement celui de l’atmosphère. L’importance de cette action apparaît déjà avec netteté dans la bible puisque l’on peut y lire qu’au premier jour de la création Dieu sépara la lumière des ténèbres. On distinguera plus spécialement dans ce chapitre :
- la formation de l’atmosphère terrestre,
- la photochimie de la basse atmosphère y inclus la pollution,
- la photochimie de la haute atmosphère et les réactions de l’ozone,
- la photochimie atmosphérique des autres planètes du système solaire.
2. La formation de l'atmosphère terrestre
Avant de regarder comment a évolué l’atmosphère terrestre, un regard minimum sur ce qu’on perçoit aujourd’hui est nécessaire. La concentration en molécules décroît au fur et à mesure que l’on monte en altitude (Fig. 6.1). Par ailleurs si cette décroissance ressemble à une relation linéaire, il n’en est pas de même de la température. Celle-ci décroît jusque vers - 50 °C, remonte quelque peu à une altitude de 40 km, puis redescend jusque - 120 °C à 100 km d’altitude, puis enfin remonte à des altitudes encore plus élevées. Cette figure indique aussi les différentes zones ou divisions admises de même que les régions (altitudes où l’on retrouve l’ozone stratosphérique), les aurores polaires et la ceinture de Van Allen.
|
|
Figure 6.1. Profils de la
température (ºC) et de la concentration d’entités chimiques [M]
de l’atmosphère en fonction de l’altitude (km).
La composition de l’atmosphère terrestre n’a pas toujours été à l’image de ce que nous connaissons aujourd’hui : figure 6.2. Il n’est pas aisé de se faire une idée exacte de cette atmosphère au moment de la naissance du Soleil et de ses planètes il y a quelque 4,6 milliards d’années. Deux hypothèses ont cours. La première admet que l’atmosphère originelle était très réductrice et contenait surtout du méthane, de l’ammoniac et de l’hydrogène à l’image de ce que l’on connaît de l’actuelle atmosphère de Jupiter : voir plus loin. La seconde hypothèse fait référence à une atmosphère modérément réductrice contenant de l’eau, du gaz carbonique et de l’azote : cette hypothèse semble la plus favorisée. Aucune de ces deux hypothèses ne retient de présence significative d’oxygène. La formation de cette molécule est très probablement d’origine photochimique :
Note: le symbole • situé avant ou après une formule chimique dénote la présence d'un électron non apparié (libre) alors que le symbole * situé après une formule indique que cette dernière se trouve dans un état excité: elle contient un surplus d'énergie interne.
| H2O + hn | ® •OH + •H | l < 240 nm |
| H2O + hn | ® H2 + O• | |
| H2O + O• | ® 2 •OH | |
| CO2 + hn | ® CO + O• | l < 230 nm |
| •O + •O + M | ® O2 + M | |
| •O + •OH | ® O2 + H• ... |
|
|
Figure 6.2. Évolution géologique
de l’écosystème terrestre.
(Inspiré de Wayne, R. P. , J. Photochem.
Photobiol., 62(3), 379 (1992)).
La concentration en oxygène s’est ainsi élevée lentement de pratiquement rien jusqu’à l’actuelle concentration. Les calculs les plus probables indiquent que cette concentration a atteint 1 % du niveau actuel il y a 2 milliards d’années, 7 % il y a 670 millions d’années et 10 % il y a 550 millions d’années. C’est vers cette époque que l’ozone, suite à la photochimie de l’oxygène (voir plus loin dans ce chapitre 4.a) a commencé à recouvrir la Terre. La concentration actuelle d’oxygène était probablement atteinte il y a 400 millions d’années.
La seconde question est celle relative à la construction d’édifices moléculaires propres à soutenir la vie. On peut diviser cette production en deux phases : une phase aérienne et une phase aqueuse. L’oxydation du méthane en phase gazeuse permet d’obtenir facilement le formaldéhyde (voir plus loin). Dans l’atmosphère primitive, les réactions précédentes suffisent pour cette synthèse :
H• + CO + M ® HCO• + M et 2 HCO• ® H2CO + CO
Le formaldéhyde est soluble dans l’eau. On a montré en outre que HCN peut aussi être synthétisé dans une atmosphère modérément réductrice. On verra aussi, dans le cas de la photochimie de l’atmosphère de Saturne, que la présence d’ammoniac permet, par photochimie, d’obtenir les amines. De telle sorte que des molécules organiques de plus en plus complexes ont vu le jour. L’apparition de la chlorophylle a, non seulement multiplié la synthèse de carbohydrates, mais a aussi décuplé la formation de l’oxygène moléculaire. L’histoire de la vie sur Terre était alors permise.
n H2O + m CO2 + hn ® Cm(H2O)n + m O2
3. La photochimie de la troposphère
Comme on vient de le voir, l’atmosphère terrestre n’a pas toujours ressemblé à ce qu’elle est aujourd’hui : même si de grandes inconnues persistent, elle a beaucoup évolué à travers les siècles. Il continuera d’en être ainsi. De façon plus intime, on verra que ce milieu est en constante évolution même s’il semble avoir atteint un équilibre dynamique. C’est donc un milieu très mouvant, susceptible de perturbations. La composition de cette atmosphère est décrite dans les tableaux 6.1 et 6.2. Les composés rapportés sont souvent regroupés sous la désignation de composés organiques volatils : les COV.
Tableau 6.1. Composition chimique (ppt) de l’atmosphère : produits mineurs observés au Royaume-Uni
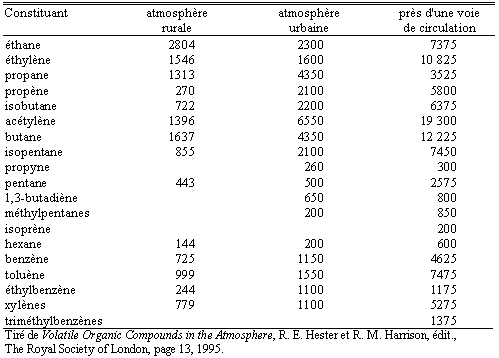
Tableau 6.2. Composition chimique de l’atmosphère : produits majeurs
| Composé |
Concentration (molécules·cm-3) |
Notes | Composé |
Concentration (molécules·cm-3) |
Notes |
| N2 | 2,3 1019 | 78,08 % | O2 | 0,5 1019 | 20,95 % |
| CO2 | 1,0 1016 | 0,038 % | Ar | 2,6 1017 | 0,93 % |
| H2O | 1,2-4,6 1017 | T | O3 | 5,8-6,4 1011 | H, S |
| HNO3 | 1012 | L | NO2 | 5 1010 | L |
| •NO | 2 1010 | L | H2O2 | 2-10 109 | H, S |
| HCHO | 6-15 109 | H, S | N2O5 | 2 107 | L |
| NO3 | 107 | H, L | HNO2 | 8 109 | L |
| CH3O2H | 7-50 109 | H | HO2• | 2-7 108 | H, S |
| CH3O2• | 6-30 107 | H | •OH | 6-10 106 | H, S |
| Notes : T : concentration variant avec la température; H : concentration variant avec l'heure du jour; S : concentration variant avec la saison; L : concentration variant avec le lessivage. | |||||
Les produits mineurs sont évidemment en petites concentrations et sont très nombreux. Leur nombre est limité par les limites de détection des appareillages analytiques. Les concentrations fluctuent aussi selon les endroits d’observation et le moment de la journée ou de l’année (Tableau 6.2).
L’étude de la dynamique de l’atmosphère revient à rechercher les constituants les plus réactifs. Plus précisément, ce sont les réactions les plus susceptibles d’avoir lieu qui intéressent les spécialistes des réactions aéronomiques. Les réactions pour lesquelles le produit de la constante de vitesse multipliée par les concentrations des réactifs est parmi les plus élevés sont les réactions les plus importantes. Il n’y a pas de règle générale tant les mécanismes sont complexes. Cependant le radical hydroxyle, •OH, est certes parmi les réactifs les plus importants (Tableaux 6.1 et 6.2).
a- Le cycle du carbone
Considérons tout d’abord le cycle du carbone, et dans un cas simple. Soit donc à étudier la chimie du méthane lorsque ce gaz est libéré dans l’atmosphère au voisinage de champs pétrolifères, dans la décomposition anaérobie de la matière organique, ou à la suite d’une activité humaine. Le schéma réactionnel 6.1 donne une idée de la suite des réactions de décomposition de cette molécule relativement simple. La première étape consiste en une attaque d’une liaison C¾H par un radical hydroxyle suivie d’une oxydation du radical méthyle résultant. Plusieurs possibilités de réduction s’offrent au radical CH3O2• : par exemple, à l’aide de l’oxyde nitrique, du radical HO2•,... Notons que le composé stable CH3O2H a besoin de lumière pour se fragmenter. Le produit dans chaque cas est le radical CH3O•. Ce dernier réagit rapidement avec l’oxygène de l’air pour former la formaldéhyde, HCHO. Ce composé, à son tour disparaît soit dans deux réactions photochimiques, soit à travers une réaction mettant en jeu les radicaux hydroxyles. On obtient, selon le cas, l’oxyde de carbone ou le radical formyle, HCO•. Ce dernier radical ne constitue qu’un intermédiaire vers la formation de CO. Finalement ce dernier composé stable est oxydé par le radical •OH. Ainsi, à travers un jeu de réactions d’oxydation-réduction, le méthane initial est entièrement transformé en gaz carbonique. Le schéma réactionnel 6.2 montre ce que peut devenir une molécule de type fréon.
En général, les mécanismes aéronomiques de destruction des composés volatils sont constitués (mais pas toujours) des étapes réactionnelles suivantes:
- attaque initiale du composé RH
par le radical hydroxyle : RH + •OH ® H2O +
•R
- oxydation d’un radical hydrocarboné par l’oxygène moléculaire :
•R + O2 ® ROO•
- réduction d’un radical peroxygéné par l’oxyde nitrique : ROO• + NO• ® RO• + NO2
- fragmentation des radicaux peu stables,
- hydrogénation des radicaux par le radical HO2• :
•R + HO2• ® RH + O2
- décomposition d’espèces stables mais photochimiquement sensibles,
- adsorption dans l’eau atmosphérique des composés
acides ou basiques,...
On voit ainsi apparaître, disparaître des composés indiqués dans le tableau 6.1 : exemples HCHO, CH3O2•... La question qui vient immédiatement à l’esprit est celle concernant la vitesse avec laquelle ce mécanisme se réalise. Compte tenu de la réactivité des radicaux •OH et des concentrations habituellement rencontrées, on estime que le temps de vie d’une molécule de méthane dans la troposphère est de l’ordre de 2 à 7 années avec une moyenne probable de 4 années! Autrement dit, on estime que si une quantité de méthane était brutalement relâchée dans l’atmosphère, au bout de 4 années on en retrouverait encore la moitié. On imagine très bien que la diffusion naturelle favorisée par les déplacements de masse d’air (le vent) a tôt fait de répartir le méthane de façon uniforme autour de la Terre. Cette concentration est de l’ordre de 1,82 ppm (± 0,05). Ce qui n’exclut évidemment pas des concentrations ponctuelles plus élevées, spécialement auprès des sources de méthane (volcans, décomposition anaérobie, raffineries de pétrole,...). On estime en outre qu’il se forme et qu’il disparaît (car le tout est normalement en équilibre) :
|
|
= 4 1011 molécules· cm-2· s-1 |
À cette quantité il correspond à une injection (et à une consommation) de 1 - 2 109 tonnes de méthane par année dans la troposphère.
|
|
Schéma 6.1. Oxydation aéronomique du méthane et de la formaldéhyde.
Une publication plus récente décrit la dynamique des radicaux peroxygénés dérivés de l'isoprène (2-méthyl-1,3-butadiène). Ce composé est libéré dans l'atmosphère à raison de 500 Tg/an par les forêts à feuilles caduques.
Qu’en est-il des autres produits chimiques libérés dans l’atmosphère? Le tableau 6.3 indique les temps de vie estimés de quelques réactifs. Le tableau suivant permet d’apprécier la longévité des fréons. À l’inverse les terpènes libérés par les forêts de conifères ont des temps de vie très courts. Les phénomènes de diffusion aidant, on explique ainsi pourquoi l’arôme des forêts de conifères ne s’apprécie qu’en sous bois ou en milieu forestier.
La quantités de terpènes naturels rejetés dans l’atmosphère par la forêt de conifères est plus difficile à évaluer. On estime la vitesse d’émission des monoterpènes à environ 1 µg par gramme de matière sèche et par heure. Au total, plutôt concentrée dans la zone équatoriale et surtout constituée d'isoprène, cette émission autour de la planète est estimée à :
|
|
= 500 106 tonnes/années (~ 500 Tg de C/an) |
|
|
Schéma 6.2. Oxydation aéronomique du fréon 134a.
Tableau 6.3. Temps de vie
calculés de quelques composés dans la troposphère
en regard de la présence des radicaux •OH, NO3•, de l’ozone et de la
photochimie
| molécules | •OH | NO3• | O3 | photochimie |
| propane | 13 j | >4500 ans | ||
| octane | 1,7 j | 250 j | >4500 ans | |
| éthylène | 1,7 j | 225 j | 10 j | |
| propène | 7 h | 4,9 j | 1,6 j | |
| isoprène | 3h | 50 min | 1,3 j | |
| a-pinène | 3 h | 5 min | 5 h | |
| benzène | 12 h | >4 ans | >4,5 ans | |
| toluène | 2,4 h | 1,9 ans | >4,5 ans | |
| o-crésol | 4 h | 3 min | 60 j | |
| formaldéhyde | 1,5 j | 80 j | >4,5 ans | 4 h |
| acétaldéhyde | 11 h | 17 j | >4,5 ans | 6 j |
| benzaldéhyde | 1,1 j | 18 j | ||
| acétone | 65 j | >1 an | 60 j | |
| 2-butanone | 13 j | |||
| méthylglyoxal | 10 h | >4,5 ans | 2 h | |
| méthanol | 15 j | >220
j |
||
| éthanol | 4,4 j | >50 j | ||
| méthacroléine | 5 h | 10 j | 1,5 j | |
| méthyl vinyl cétone | 9 h | 3,6 j | ||
| méthyl hydroperoxyde | 2,6 j | 5 j | ||
| nitrate de 2-butyle | 16 j | 15-30 j | ||
| j = jour, h = heure; Tiré de "Volatile Organic Compounds in the Atmosphere", Hester, R. E. et R. M. Harrison, édit., The Royal Society of London, page 71, 1995. | ||||
Tableau 6.4. Temps de vie de quelques molécules M dans la troposphère
| M | ans | M | ans | M | mois | M | jours | min | s |
| CH4 | 4,1 | CF2ClCFCl2 | 85 | H2 | 4,5 | CH3SCH3 | 18 | ||
| CF2HCl | 7 | CF2ClCF2Cl | 300 | CO | 30 | 2-butène | 4 | ||
| CCl4 | 35 | CF2ClCF3 | 1700 | SO2 | 15 | limonène | 36 | ||
| CFCl3 | 45 | CF2Cl2 | 100 | a-terpinène | 16 | ||||
| En partie, tiré de Wayne, R. P., Chem. of the Atmosphere, 2e éd., Oxford Sc. Publ., 1991 et de http://www.epa.gov/ozone/ods.html | |||||||||
|
|
Schéma 6.3. Les cycles
troposphériques du carbone,
Réf. : Levy II, H., Adv. Photochem.,
9, 369 (1974).
|
|
Schéma 6.4. Les cycles
troposphériques de l’azote.
Réf. : Levy II, H., Adv. Photochem.,
9, 369 (1974).
Note : Pendant la nuit les réactions
photochimiques disparaissent.
Tableau 6.5. Principales réactions de consommation des terpènes le jour
| Terpènes | k(O3)* | % | k(·OH)* | % |
| a-pinène | 1 - 2 105 | 52 | 3,5 1010 | 48 |
| b-pinène | 2,2 104 | - | 4,1 1010 | > 90 |
| d-limonène | 3,9 105 | - | 9,0 1010 | > 80 |
| * : constante de vitesse exprimée en litre· mol-1·s-1 | ||||
On estime que l'injection naturelle par le couvert forestier est d'environ 550-600 106 t/an pour l'isoprène et de 130-150 106 t/an pour les monoterpènes. Certains modèles indiquent plutôt plus de 500 106 t/an pour les monoterpènes. On voit ainsi que s’il y a une injection de produits chimiques dans l’atmosphère, par suite de l’activité humaine - la pollution -, ces quantités viennent s’ajouter à ce qui est naturellement injecté. On estimait que, vers la fin des années 60, les quantités relatives de ces deux sources d’hydrocarbures étaient à peu près équivalentes. Il en résulte que la dynamique chimique de l’atmosphère est soumise à un stress supplémentaire. Il faut enfin ajouter que les polluants hydrocarbonés n’ont pas nécessairement les mêmes propriétés que les "polluants" naturels. On estime en effet que le temps de vie moyen d’une molécule terpénique dans la troposphère n’est que de 4 minutes. Cela est beaucoup plus court que ceux des hydrocarbures dérivés de l’industrie pétrolière, de l’usage des automobiles, ... Voir le schéma 6.1.
b- Le cas de l’azote
Les réactions sont moins bien connues que dans le cas du carbone :
| NH3 + •OH | ® H2O + •NH2 | k = 1,5 10-13 molécules·cm-3·s-1 |
| •NH2 + NO• | ® H2O + N2 | k = 2,3 10-11 molécules·cm-3·s-1 |
| •NH2 + NO2 | ® H2O + N2O | k = 2,3 10-11 molécules·cm-3·s-1 |
| •NH2 + O3 | ® NOx + ? | k = 6,3 10-14 molécules·cm-3·s-1 |
On l’a déjà vu à propos de l’oxydation du méthane, les oxydes d’azote jouent un rôle crucial dans les processus d’oxydoréduction des hydrocarbures. En particulier, la séquence
R• + O2 ® ROO•
ROO• + NO• ® RO• + NO2
est très bien connue. Il faut mentionner le cas particulier du radical NO3 particulièrement important pendant la nuit. Pendant la journée, ce radical est photodécomposé. Pendant la nuit, il s’accumule. Comme en outre, c’est une molécule très réactive, elle modifie considérablement la chimie de l’atmosphère. Par exemple, si le b-pinène disparaît le jour par réaction avec le radical ·OH, la nuit, il disparaît en réagissant avec cet oxyde d’azote. Voir plus particulièrement le schéma 6.3.
c- Le cas du soufre
La chimie de l’atome de soufre dans l’atmosphère est moins bien connue que celle du carbone. Les nombreux états d’oxydation de cet atome ne simplifient pas non plus sa compréhension bien que, récemment, sous l’influence du problème des pluies acides, de nombreux travaux ont été orientés vers cette compréhension.
Gaz industriel, sous-produit de nombreuses industries, c’est aussi un composé produit naturellement par les volcans et certaines décompositions anaérobies.
| H2S + •OH | ® H2O + •SH | k = 7,5 10-12 molécules·cm-3·s-1 |
| HS• + H2O· | ® HSO + •OH | k = 1,1 10-11 molécules·cm-3·s-1 |
| HS• + O3 | ® HSO• + O2 | k = 3,5 10-14 molécules·cm-3·s-1 |
| HS• + H2O2 | ® H2S + HO2• | k = 5 10-13 molécules·cm-3·s-1 |
| HS• + CH3O2H | ® H2S + CH3O2• | k = 5 10-13 molécules·cm-3·s-1 |
| HS• + HO2· | ® H2S + O2 | k = 3 10-11 molécules·cm-3·s-1 |
| HS• + HCHO | ® H2S + HCO• | k = 1 10-12 molécules·cm-3·s-1 |
| HSO• + ??? | ® SO4-- , HSO4- | aérosols, pluies acides, etc. |
| CH3SH + •OH | ® H2O + CH3S· | k = 3,39 10-11 molécules·cm-3·s-1 |
| CH3S• + O2 | ® CH3SO2 | k = 6 10-16 molécules·cm-3·s-1 |
| CH3SO2 + NO• | ® CH3SO• + NO2 | k = 5 10-13 molécules·cm-3·s-1 |
| CH3SO• + ??? | ® SO4-- , HSO4- | aérosols, pluies acides, etc. |
Le schéma réactionnel 6.5 donne une idée plus juste de la complexité des réactions impliquées dans cette chimie. Comme on peut le voir, ces composés sont des initiateurs d’aérosols, de pluies acides,... Il fut un temps où la principale source de pollution par le soufre provenait de l’oxydation domestique du charbon, lui-même riche en soufre. Le brouillard londonien était bien connu pour le fameux smog dont la principale source provenait des millions de chauffages des maisons privées.
|
|
Schéma 6.5. Chimie aéronomique du
méthanethiol.
réf. : Yin, F. et al., J. Geophys.
Res., 91, 14 417 (1986).
d- Le brouillard californien
L’analyse d’échantillons d’air au cours d’une journée de 24 heures dans une grande ville comme Los Angeles montre des variations de concentrations de polluants qui suivent la densité de la circulation automobile : Fig. 6.3. Les concentrations de NO• et de NO2 suivent le pic de circulation du matin. Le phénomène est moins prononcé en fin de soirée. La circulation automobile est plus étendue dans le temps et la photochimie y est moins importante qu’en matinée. Dans un moteur à pistons, il y a synthèse d’oxyde nitrique: N2 + O2 ® 2 NO• . À l’air, l’oxyde nitrique s’oxyde en bioxyde d’azote : 2 NO• + O2 ® 2 NO2. Il s’ensuit un mécanisme photochimique dont la réaction globale est nulle :
| NO2 + hn ® NO· + O•(3P) | } Réaction globale nulle. |
| O•(3P) + O2 + M ® O3 + M | |
| O3 + NO• ® NO2 + O2 |
On atteint un régime photo stationnaire et la concentration en ozone croît avec l’intensité de la lumière. Ainsi, pendant la nuit, la formation de l’ozone est pratiquement absente. Cependant la chaîne est interrompue par la présence des doubles liaisons des hydrocarbures libérés dans l’atmosphère par les essences. De plus, lorsque la concentration en NO· décroît, la concentration en ozone augmente. L’irritation des muqueuses pulmonaires, des yeux devient maximum. Le brouillard résultant a la composition typique suivante :
|
|
Figure 6.3. Variations des
concentrations
des principaux polluants du brouillard californien.
O3
+ h n
(l <
318 nm) ®
O• (1D) + O2 (1Dg)
O• (1D) + H2O ®
2 •OH
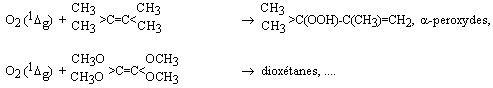
Note : la notation (1Dg) réfère à une molécule d’oxygène se trouvant dans son état électronique excité (1Dg).
Comme on vient de le voir avec les dérivés hydrocarbonés, azotés et soufrés les radicaux hydroxyles louent un rôle crucial dans l’amorçage des réactions de fragmentation de plusieurs composés organiques volatils : en anglais les VOCs. On les surnomme à l’occasion le détergent de l’atmosphère faisant ainsi référence à leur pouvoir « nettoyant » de l’atmosphère. La connaissance et l’estimation la plus précise possible des sources de ces radicaux est donc d’une grande importance en particulier dans l’utilisation des modèles informatiques simulant la dynamique de l’atmosphère. En atmosphère polluée, la photodécomposition de l’ozone dans la troposphère constitue très certainement la principale source.
NO2 + hn (420 < l < 650 nm) ® NO2*
NO2*
+ H2O
®
·OH
+
HONO
HONO +
hn
( l
<
390 nm)
®
•OH
+
NO•
Il reste donc des points importants à élucider ne serait-ce que pour améliorer les résultats des simulations informatiques de la dynamique de la troposphère. Ces améliorations permettront à leur tour une meilleure prise de décision dans la gestion de l’environnement.
4. La photochimie de la stratosphère
La stratosphère est cette région de l’atmosphère située entre 20 et 40 km d’altitude. Caractérisée par des températures relativement froides (-50 °C), cette région est surtout bien connue par la présence d’ozone, O3 (Fig. 6.4). Cette présence est primordiale pour maintenir la vie organisée sur notre planète. En effet, la couche d’ozone (équivalente à une pression de 3,7 mmHg) absorbe certains rayonnements UV (Fig. 6.5) qui autrement en arrivant au sol provoqueraient des altérations de l’ADN. Le bagage génétique en serait tellement perturbé que l’on "assisterait" à une désertification, à la disparition de la vie. Les modèles les plus récents prédisent une augmentation annuelle des cancers de la peau de 2 % avec une diminution de 1% de l’épaisseur de la couche d’ozone.
|
|
Figure 6.4. Variations de la
concentration de l’ozone dans la stratosphère
* : Crutzen, P., Can. J. Chem., 52,
1569 (1974);
** : Krueger, A. J. et al., Pure Appl. Geophys., 106-108, 1325
(1973).
|
|
Figure 6.5. Spectre d’absorption de l’ozone et lumière solaire transmise au sol.
a- La formation de l’ozone
Cette couche d’ozone n’est pas statique. La concentration de ce composé est le résultat d’un équilibre entre des réactions de formation et de destruction. L’oxygène moléculaire absorbe le rayonnement UV dans la région de 140 - 220 nm. Il y a formation de deux atomes d’oxygène. Ceux-ci réagissent avec de l’oxygène moléculaire formant l’ozone. L’ozone ainsi formé absorbe à son tour le rayonnement ultraviolet situé entre 200 et 280 nm. Il se fragmente en oxygène moléculaire et en un atome d’oxygène à nouveau libre pour régénérer une autre molécule d’ozone. Le résultat est un mécanisme en chaîne entretenu par le rayonnement UV et où les atomes d’oxygène jouent le rôle de porteurs de chaîne. La réaction de rupture de chaîne implique la réaction entre un atome d’oxygène et une molécule d’ozone.
cycle de formation de l’ozone :
| O2 + hn | ® O•(1D) + O•(3P) | l < 176,0 nm | amorçage de la chaîne |
| O2 + hn | ® O•(3P) + O•(3P) | l < 242,4 nm | amorçage de la chaîne |
| O• +O2 + M | ® O3 + M | M º N2, O2 | propagation |
| O3 + hn | ® O•(1D) + O2(a1Dg) | l < 307,5 nm | propagation |
| O• + O3 | ® 2 O2 | rupture de la chaîne |
b- L’effet des Concordes
L’équilibre précédemment atteint peut être facilement perturbé. Une première possibilité provient des injections d’oxydes d’azote résultant de la combustion de carburants dans les moteurs d’avions et plus spécialement ceux volant immédiatement au voisinage ou dans cette couche d’ozone. Alors que les avions commerciaux actuels volent vers 10 - 12 000 mètres, donc assez loin de l’ozone, les Concordes (et leurs frères, les Tupolevs) volent à une altitude de 20 000 mètres, donc assez proche de la couche pour perturber le mécanisme réactionnel précédemment décrit (voir Fig. 6.2) :
NO• + O3
®
NO2 + O2
O• + NO2
®
NO• + O2
Globalement :
_________________________
O• + O3
®
2 O2
L’effet net est une destruction de l’ozone dans un mécanisme en chaîne linéaire. Si rien ne vient arrêter ce mécanisme, on peut appréhender des conséquences néfastes. Le modèle complet requiert la connaissance de toutes les constantes de vitesse de réactions, les vitesses d’injection des oxydes d’azote. Le résultat indique que si une flotte de 500 Concordes volaient 7 heures par jour, tous les jours de l’année, la diminution de l’épaisseur de la couche d’ozone ne serait que de 2 ou 3 %. L’effet est donc mineur, mais est révélateur des limites à ne pas dépasser.
c- L’effet des fréons
Jusque vers la fin du dernier siècle, l’industrie des fréons produisait chaque année au-delà d'un million de tonnes de fréons, substances aux propriétés intéressantes. En particulier, ces molécules, comme les fréons 11 (CFCl3) et 12 (CF2Cl2), présentent un inertie chimique quasiment exemplaire : voir plus loin le tableau 6.8. Ils ont la particularité de ne réagir avec rien, faisant ainsi preuve d’une absence de toxicité remarquable. En plus de l’usage comme fluide caloporteur, on les retrouvait dans l’industrie électronique comme agent nettoyant, dans les aérosols comme agent propulseur, dans l’industrie des plastiques,... Que deviennent ces molécules une fois relâchées dans la troposphère? Compte tenu de leur temps de résidence, ils diffusent dans l’atmosphère horizontalement et, même s’ils sont plus lourds que l’air, verticalement. Après 10 - 15 ans, on en retrouve au milieu de la couche d’ozone. À 25 km d’altitude, ces molécules rencontrent des photons UV de courtes longueurs d’onde (l < 230 nm) qu’elles absorbent. Les molécules photoexcitées se fragmentent libérant des atomes de chlore. Ceux-ci introduisent un mécanisme en chaîne de destruction de l’ozone.
CF2Cl2 + hn ® •CF2Cl + Cl•
Cl• + O3
®
ClO• + O2
O• + ClO• ®
Cl• + O2
Globalement :
____________________________
O• + O3
+ hn
® 2 O2
Cette chaîne linéaire peut être très longue et s’avérer d’une grande efficacité. Les premiers calculs montraient (@ 1975) que, compte tenu des quantités de fréons déjà libérés dans l’atmosphère, on aurait déjà dû subir une diminution de la couche d’ozone de quelque 20 % (!) avec les conséquences que cela aurait dû entraîner. Heureusement nous n’en sommes pas là!
Ce mécanisme est perturbé par
les oxydes d’azote. Le bioxyde d’azote, NO2, s’additionne sur le monoxyde de
chlore, donnant lieu à la formation de nitrate de chlore. Sous l’influence de la
lumière, ce produit se redécompose. Cependant, pendant un temps relativement long, les
atomes de chlore sont piégés : il y a constitution d’un réservoir d’atomes de chlore.
L’oxyde nitrique, de son côté, réagit avec le monoxyde de chlore par arrachement de
l’atome d’oxygène. Le NO2 ainsi formé piège le monoxyde de chlore ou est photodécomposé par le rayonnement lumineux, libérant ainsi de nouveaux
atomes d’oxygène disponibles pour régénérer l’ozone. Globalement, les oxydes
d’azote
ont un effet modérateur sur l’effet dévastateur des atomes de chlore.
| ClO• + NO2 | ClONO2 | |
| ClO• + NO• | ® | Cl• + NO2 |
| NO2 + hn | ® | NO• + O• |
L'oxyde nitrique, NO•, réagit avec le monoxyde de chlore par
arrachement de l’atome d’oxygène. Le NO2
ainsi formé piège le monoxyde de chlore sous la forme de ClONO2 (voir plus haut) ou est photodécomposé
par le rayonnement lumineux, libérant ainsi de nouveaux atomes d’oxygène
disponibles pour régénérer l’ozone. Globalement, les oxydes d’azote ont un
effet modérateur sur l’effet dévastateur des atomes de chlore.
En fait, HCl et ClONO2 sont transformés en formes beaucoup plus réactives sur la surface des nuages polaires stratosphériques. Ces réactions sont :
HCl
+ ClONO2
®
HNO3
+ Cl2
ClONO2 + H2O
®
HNO3
+ HOCl
HCl
+ HOCl
®
H2O
+ Cl2
N2O5
+ HCl
®
HNO3
+ ClONO
N2O5
+
H2O
® HNO3
Le mécanisme régénère le chlore moléculaire. Un modèle plus réaliste est sûrement plus compliqué et met en cause d’autres réactions. L’acide nitrique demeure absorbé sur les particules constituant le nuage stratosphérique, diminuant ainsi la concentration les concentrations d’oxydes d’azote, permettant ainsi aux atomes de chlore de poursuivre leur action dévastatrice. Comme cela est indiqué plus haut diverses espèces sont momentanément piégées (on appelle cela un réservoir). Des atomes de brome provenant entre autres sources de l'utilisation du bromure de méthyle dans la culture maraichère s'insèrent également dans ce mécanisme (Fig. 6.6).
Figure 6.6. Implications des atomes de brome dans les réactions de destruction
de l'ozone par les atomes de chlore.
Inspiré de L'actualité chimique, 385-398,
86-90 (juin-juillet 2015).
Avec ces considérations les modèles sont moins alarmistes. Cependant, pour avoir une vision réaliste, il faut réaliser que l’effet des fréons est un effet retardé. En estimant le temps de vie à 10 ans d’un système de réfrigération - la vie estimée d’un réfrigérateur - le fréon acheté en 1990 risque d’être libéré dans l’atmosphère en l’an 2 000 ou quelques années plus tard. Attendons encore 25 ans avant qu’il n’arrive dans la stratosphère, et ses effets sur la couche d’ozone ne se feront pas sentir avant 2 025. On ne peut bien sûr attendre ce moment pour vérifier si les modèles sont pessimistes ou optimistes. D’où l’action des gouvernements (protocole de Montréal en vigueur le 89-01-01) qui veulent bannir à court terme l’usage de cette bombe à retardement. On estimait à environ 100 000 tonnes la production de fréon en 2004, une réduction significative.
d- Le trou dans la couche
d’ozone au pôle sud (ou mieux l'amincissement de la
couche d'ozone au pôle sud)
Cette urgence a été mise en évidence par l’apparition au cours de chaque printemps austral (octobre, novembre) d’une immense diminution de la couche d’ozone au-dessus du continent antarctique : figure 6.7A. Au cours des années 1980-2000 une équipe de chercheurs a mesuré l’épaisseur de la couche d’ozone au-dessus de ce continent. Cette épaisseur a été caractérisée par une décroissance lente puis plus accentuée pendant le printemps austral. Mesurée en DOBSON (1 Dobson @ 0,01 mmHg), la couche d’ozone a diminué d’à peu près 40 % entre 1975 et 1985. La couche atteignait un minimum record de 90 Dobsons en 1998! (94 Dobsons en 2009) (Fig. 6.7A). Cet effet est non permanent : avant la fin du printemps, la couche d’ozone se reconstitue. Cette situation s’aggravait d'année en année entre 1975 et 1995, il était évidemment important d'en analyser les causes afin de savoir si l'atmosphère de la planète était en danger et éventuellement de supprimer les causes de cet affaissement et d'en évaluer les conséquences. La première est celle liée à l’augmentation de l’irradiation ultraviolette (Fig. 6.8) source éventuelle de mélanome de la peau.
|
|
 |
Figure 6.7. Déclin de la quantité d'ozone aux printemps
(A) austral et (B) arctique.
Cliquez aussi ici :
http://ozonewatch.gsfc.nasa.gov/
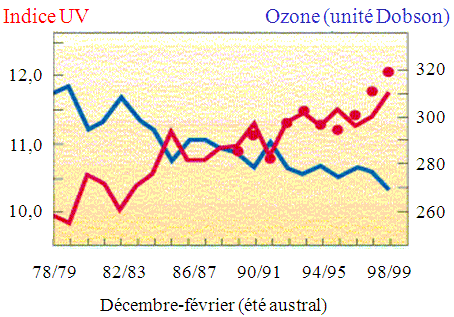 |
Figure 6.8. Parallélisme entre la
diminution de la couche d'ozone stratosphérique et l'augmentation de cancers de
la peau.
(Source :
Chem. & Eng. News,
13 septembre 1999).
Ce phénomène est lié à des conditions géoclimatiques particulières régnant au pôle
sud. Pendant l’hiver austral, sous l'influence de températures extrêmes, de
la présence d'un continent émergé et de courants marins circumpolaires, il se crée un immense vortex (Fig. 6.9A
et 6.10) au-dessus du
continent antarctique. Ce vortex isole une énorme masse d’air du reste de l’atmosphère.
L’ozone est alors consommé en grande partie à travers la chaîne impliquant les atomes
de chlore, donc les fréons. Comme la synthèse de l’ozone demande de la lumière surtout
disponible en été et au voisinage de l’équateur, l’équilibre est fortement déplacé
vers une diminution importante de sa concentration. En outre, les oxydes d’azote ne
semblent pas jouer leur rôle modérateur. On a pu montrer que la température extrême
rencontrée au pôle sud (parfois moins de - 80 °C), joue aussi un rôle négatif. À ces
températures, il se forme, dans l’atmosphère, des mini-cristaux de glace qui piègent
sur leur surface les oxydes d’azote. Ceux-ci ne peuvent plus jouer de rôle modérateur.
Le vortex disparaissant au printemps, le mélange avec de l’air plus riche en ozone se réalise et la concentration en ozone se rétablit. Pendant l’hiver 1987, contrairement à la normale, le vortex ne s’est établi que pendant un temps très court et de façon incomplète. Il en a résulté une homogénéisation plus grande de l’atmosphère autour du pôle sud, diminuant ainsi de façon marquée l’importance de l'amincissement de la couche d’ozone. Cet effet dramatique a certainement aidé les dirigeants à faire preuve de prudence vis-à-vis un usage inconsidéré des fréons.
|
A |
|
B |
|
Figure 6.9. Le vortex antarctique
au début du printemps austral (mi-septembre 1987) et ses conséquences sur la
concentration en ozone.
La physique du vortex (A) transforme radicalement la chimie (B) de la
stratosphère créant l'amincissement dans la région perturbée.
Figures inspirées de Pilling, M.
J. et P. W. Seakins, Reaction Kinetics, Oxford Sc. Publ., Oxford 1996.

Figure 6.10. Le vortex
antarctique tel qu’observé (en fausses couleurs) en octobre 1989 :
On pourra reconnaître à l’avant de la
figure la pointe sud de l’Amérique latine et à gauche celle de l’Afrique. Les
concentrations en ozone sont indiquées en couleur, le rouge correspondant à la
concentration la plus faible et le bleu à la concentration la plus forte.
Note : le site web où a été capté cette image ne semble plus exister ?
La réaction de disparition de l’ozone impliquerait la molécule ClOOCl et dans une moindre mesure ClOOBr. La chaîne réactionnelle serait efficace durant le jour et serait la suivante :
ClOOCl + hn ® Cl + ClOO• réaction suivie de
ClOO• ®
Cl• +
O2
2
[ Cl• + O3
®
ClO• + O2]
2
ClO• ®
ClOOCl
Le même phénomène soupçonné est apparu de manière claire au printemps 1995 dans la
zone arctique, "centré" sur la Sibérie. Pourquoi ce phénomène n’est-il
apparu que 20 ans plus tard dans cette région? À cela, il y a au moins deux raisons (pas
nécessairement indépendantes). La première tient au fait que la température moyenne
hivernale dans l’hémisphère nord est de quelques degrés supérieurs à celle
rencontrée dans l’hémisphère sud. En outre, le vortex identifié dans la région
antarctique ne s’implante que difficilement dans la région arctique. Les conditions
favorables rencontrées au pôle sud font donc défaut dans la région arctique
(Fig. 6.7B).
Pourtant, un vortex a pu s’installer en fin mars 1995. Du coup, la concentration en ozone, vers 18 km d’altitude, était de quelque 40 % plus faible le 20 mars 1995 que ce qu’elle était le 18 mars 1992 et cela au-dessus de la Norvège.
Finalement, en revenant à la figure 6.7A, depuis la mise en place du protocole de Montréal qui visait l'élimination progressive de la fabrication et la commercialisation des CFC, on semble observer une diminution de l'importance du trou d'ozone à partir du milieu des années 90 (ligne pointillée rouge). Cette évolution est très lente et on ne prévoit pas de retour aux conditions qui prévalaient en 1970 avant le milieu de ce siècle, voire 2060. De récentes observations basées sur la surface de ce trou tendent à confirmer un lent processus de récupération.
5. La photochimie de l’ionosphère
Cette partie de l’atmosphère, située grossièrement entre 90 et 250 km d’altitude, est caractérisée par la présence d’électrons libres ainsi que par une température croissant rapidement avec l’altitude. La concentration typique en ions libres est de l’ordre de 105-106 ions·cm-3. La densité électronique maximum est située vers 200 km. Les principales sources de ces ions sont :
| O· + hn | ® O+ + e- |
| O2 + hn | ® O2+ + e- |
| ® O• + O+ + e- | |
| N2 + hn | ® N2+ + e- |
| ® N• + N+ + e- |
Plusieurs réactions de type
ion-molécule suivent. Notons parmi les plus importantes :
N2+ + O• ® NO+ + N• k = 1,5 1011 mol-1· s-1
N2+ + O2 ® N2 + O2+ k = 6 1010 mol-1· s-1
O+ + N2 ® NO+ + N• k = 1,2 109 mol-1· s-1
O+ + e- ® O•* O•* ® O• + hn
N2+ + e- ® N• + N•* N•* ® N• + hn
NO+ + e- ® N• + O• ... etc.
Les atomes d’azote sont alors rapidement transformés en atomes d’oxygène :
N• + NO• ® N2 + O• k = 1,3 1010 mol-1· s-1
N• + O2 ® NO• + O• EA = 29 kJ·mol-1
Si la seconde réaction est plutôt lente, à cause de son énergie d’activation, il n’en est pas de même pour la précédente. À cette altitude (200 km) les réactions thermoléculaires sont très lentes (pression faible), il s’ensuit que les réactions de recombinaison atomique sont rares. Les atomes d’oxygène diffusent alors vers les couches plus basses de l’atmosphère. Vers l’altitude de 100 km, ces atomes d’oxygène réagissent entre eux :
3 O• (3P) ® O2 + O• (1S)
Les notations (3P) et (1S) représentent, respectivement, des atomes d’oxygène dans l’état fondamental et dans un état électronique excité. Ces atomes excités, O· (1S), ainsi que ceux qu’ils produisent, O· (1D), représentent la principale source de la lueur du ciel observable la nuit. Une composante de cette lueur est liée à la transition radiative suivante :
O• (1S) ® O• (1D) + 557,7 nm (t = 0,71 s)
O• (1D) ® O• (3P) + 630,0 nm (t = 150 s)
Les aurores boréales surviennent généralement dans cette région (entre 100 et 200 km d’altitude). Le vent solaire constitué principalement d’espèces chargées (électrons, protons) est focalisé aux pôles par le champ magnétique terrestre : la magnétosphère. Pendant les orages magnétiques le courant électrique charrié par les électrons se mouvant à très haute vitesse peut atteindre 107 ampères. Une faible partie (environ 5%) de l’énergie de ces électrons sert à exciter les atomes, les molécules et les ions de cette région. Ces espèces excitées fluorescent et donnent ainsi lieu aux aurores boréales : les atomes d’oxygène excités émettent dans le vert et les atomes d’azote dans le rose.
6. L'effet de serre
L’augmentation de la température de la Terre est maintenant un phénomène assez bien établi. Les mesures à l’aide de satellites confirment les observations effectuées par ailleurs depuis près d’un siècle par des mesures plus conventionnelles ou par des méthodes indirectes (figure 6.10). Par exemple, la température des océans peut se mesurer aisément. Il est à noter la croissance très élevée de la température relevée au cours de 25 dernières années, phénomène jusqu’ici inobservé.
|
|
Figure 6.11. Variabilité de la
température de la Terre observée sur des périodes de 5 années.
(Chem & Engin. News, 45, (janvier
1999)).
L’effet de serre appliqué à la Terre est connu depuis longtemps : il a d’abord été
décrit par
ARRHÉNIUS en
1896. Le principe en est simple. Le rayonnement ultraviolet et visible qui arrive du Soleil est
absorbé par le sol et est éventuellement restitué sous la forme de rayonnement
infrarouge. Or la vapeur d’eau, le gaz carbonique, le méthane et même les fréons sont
aussi capables d’absorber dans la même région de l’infrarouge, parfois même là où
l’eau n’absorbe pas. Ce "piégeage" de la radiation infrarouge entraîne le
réchauffement des basses couches de l’atmosphère et cela d’autant plus que la
concentration d’espèces absorbantes est grande. C’est là, au moins partiellement,
l’explication du refroidissement de l’atmosphère au fur et à mesure que l’on
s’élève
en altitude jusqu’à la tropopause. De la même manière, les nuits couvertes, tout
particulièrement en hiver, sont plus chaudes que les nuits étoilées.
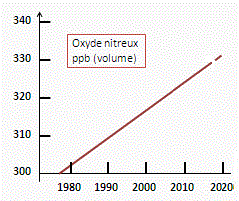
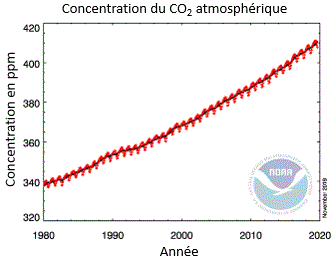
Dans ce contexte, une augmentation de la concentration de produits absorbant l’infrarouge augmentera la température de la planète. Plus l’homme injecte de gaz carbonique, de méthane,... dans l’atmosphère et plus on peut prévoir ce réchauffement. On peut penser qu’avec l’avènement de l’industrialisation au milieu du XIXe siècle, la combustion des ressources énergétiques fossiles, du charbon, du pétrole puis du gaz naturel, la concentration de CO2 n’a fait que croître. On ne dispose cependant que de peu de données. La station située au sommet du volcan Mauna Loa à Hawaï mesure la concentration de ce gaz depuis une soixantaine d’années et cette concentration est passée de 315 à ~ 408,5 ppm en octobre 2019. Si cette tendance se maintient, cette concentration pourrait atteindre 550 ppm en 2035. D’un autre côté, les météorologues disposent de suffisamment de preuves pour affirmer que la température moyenne du globe a augmenté de près 0,9 °C depuis un siècle sans pour autant affirmer que ce réchauffement soit exclusivement dû au CO2. Si l’effet de ce gaz carbonique devait se confirmer, au rythme actuel de la consommation de l’énergie, on estime qu’il pourrait en résulter une augmentation de température moyenne de 1,5 à 4,5 °C en l’an 2 050! L'augmentation annuelle de la concentration en méthane ne semble pas vouloir s'arrêter.
En ce qui concerne le méthane, les analyses de bulles gazeuses contenues dans les glaces sédimentées au Groenland montrent sans ambiguïté que si la concentration du méthane s’est maintenue autour de 0,7 ± 0.1 ppm depuis 10 000 ans jusqu’au début du XIXe siècle, l’industrialisation avec l’utilisation massive des sources fossiles d’énergie a fait croître cette concentration. Les mesures obtenues en juillet 2019 en phase gazeuse tournent autour de 1,86 ppm pour cette concentration.
Cette augmentation n’ira pas sans modification du climat général de la planète. Il fera plus chaud au Québec : ce n’est pas un mal! La forêt poussera plus vite : c’est aussi un avantage. Les calottes glaciaires diminueront et les basses terres pourront être inondées : pauvre Floride et pauvres stations de skis du nord de Montréal! Ce ne sont là que quelques conséquences qu’il est bien difficile d’apprécier avec justesse. Avant de jouer au "prophète", il y a lieu de bien comprendre le cycle du carbone atmosphérique, non seulement aujourd’hui mais également dans le lointain passé pour mieux comprendre la complexité de la dynamique de l’atmosphère et l’importance des injections humaines de gaz carbonique.
|
|
Figures 6.12. Variations de la température au
cours des âges ainsi que de la concentration
du méthane dans l’atmosphère terrestre.
 |
 |
| Figures
6.13. Augmentation de la concentration de l’oxyde nitreux dans l’atmosphère terrestre au cours des années quatre-vingts - 2020. Note : 331 ppb en septembre 2018. |
Figures 6.14.
Augmentation de la concentration du gaz carbonique au cours des quarante dernières années. |
Le cycle géologique du carbone
Dans un premier temps, il faut établir le bilan le plus exact possible des sources et des
dépôts de carbone et dans un deuxième temps, évaluer le transfert de ce carbone entre
ces différentes sources et dépôts ainsi que les facteurs qui les gouvernent. Le tableau
6.6 fait état des estimations des dépôts de carbone. Cet estimé, même inexact, montre
que presque la totalité du carbone est située dans les roches sédimentaires. Par contre,
le carbone atmosphérique, même s’il ne représente qu’une infime partie du total, joue
un rôle clef dans le support de la vie et bien entendu dans un effet de serre
appréhendé. Il faut donc pouvoir estimer aussi précisément que possible les vitesses
de transfert de CO2 vers le sol, vers les océans ainsi que les chemins
inverses.
Le CO2 atmosphérique, avec l’eau de pluie, lave le sol où il attaque les roches carbonatées en solubilisant le carbonate de calcium sous la forme d’ions Ca++ et bicarbonates. Ces ions sont entraînés vers les océans où, en plus de supporter la vie, le CaCO3éventuellement se reforme et précipite avec libération de CO2 dans l’atmosphère. Ce mécanisme n’entraîne aucune perte de gaz carbonique pour l’atmosphère. La désagrégation similaire des silicates se traduit au contraire par une perte nette de CO2.
Tableau 6.6. Bilans du carbone terrestre
| État du carbone | Masse absolue * | Masse relative |
| CaCO3 : roches sédimentaires | 35 000 | 62 500 |
| Ca-Mg(CO3)2 : roches sédimentaires | 25 000 | 44 500 |
| matières organiques sédimentaires | 15 000 | 26 800 |
| CO3-- et HCO3- dissout dans les océans | 36 | 64 |
| carburants fossiles | 4,0 | 7,1 |
| carbone mort (humus) | 3,0 | 5,4 |
| CO2 atmosphérique | 0,73 | 1,3 |
| règnes vivants | 0,56 | 1 |
| * : 1012 tonnes ; Berner, R. A. et A. C. Lasaga, Scientific American, 74, mars 1989. | ||
| CO2 + H2O + CaCO3 | ® Ca++ + 2 HCO3- |
| Ca++ + 2 HCO3- | ® CaCO3 (s) + CO2 (g) et |
| 2 CO2 + H2O + CaSiO3 | ® Ca++ + 2 HCO3- + SiO2 |
| 2 HCO3- + Ca++ | ® CaCO3 (s) + CO2 (g) + H2O |
| Globalement : | |
| CO2 + CaSiO3 | ® CaCO3 (s) + SiO2 |
Ce processus, depuis qu’il existe, aurait dû épuiser tout le CO2 atmosphérique. Il doit donc être compensé par une source de CO2. L’accumulation de carbonates au fond des océans, auxquels s’ajoutent les dépôts calcaires des squelettes d’animaux constituent d’énormes réservoirs de carbone. Ceux-ci, par subduction, se glissent sous les plaques continentales et s’enfoncent de plus en plus profondément dans la croûte terrestre. Ils y rencontrent des températures de plus en plus élevées de telle sorte qu’ils se décomposent : c’est le phénomène du métamorphisme. Le dégagement de gaz carbonique qui en résulte peut être violent (c’est le cas du volcanisme) ou lent. Il donne alors lieu à la résurgence de sources carbonatées.
CaCO3 + SiO2 ® CaSiO3 + CO2
La décomposition aérobique de la matière vivante ajoute à la réintégration du carbone dans l’atmosphère. Le mécanisme principal étant connu, il faut maintenant en évaluer la dynamique. Évaluer l’importance et la vitesse des réactions de lavage acide des roches sédimentaires ou des silicates n’est pas simple, encore moins de la décomposition des carbonates dans les profondeurs terrestres. Les modélistes doivent donc faire preuve de discernement dans la définition de ces modèles ainsi que dans l’estimation des vitesses de transfert de matière (voir schéma 6.3). En outre, la température de l’atmosphère de même que la concentration de gaz carbonique n’ont pas toujours été ce qu’elles sont aujourd’hui. La concentration de CO2 a déjà pu être de 30 à 35 fois plus élevée il y a 100 000 000 d’années... engendrant une période de végétation luxuriante à l’époque du Carbonifère.
|
|
Figure 6.15. Cycle schématique et géologique du carbone.
Dans ce contexte général où les imprécisions et même les inconnues sont souvent plus importantes que les choses sûres, il est prématuré de prédire les effets à long terme de l’injection supplémentaire de gaz carbonique dans l’atmosphère. Sans tomber dans l’optimisme, ou le pessimisme, il y a lieu d’être prudent. L’accélération de l’injection de CO2 vient court-circuiter les mécanismes naturels et ajouter au stress ou déplacer un équilibre qui s’est construit sur plusieurs millions d’années. Il est donc naturel et nécessaire de se préoccuper des actions humaines sur l’environnement.
Tableau 6.7. Échange de carbone entre le sol et l’atmosphère
| Processus d’échange | Sens | 109 tonnes/an |
| diffusion physico-chimique | Ý | + 100 |
| diffusion physico-chimique | ß | - 104 |
| respiration des sols | Ý | + 50 |
| photosynthèse | ß | - 100 |
| respiration végétale | Ý | + 50 |
| déforestation | Ý | + 2 |
| combustibles fossiles | Ý | + 5 |
| Bilan | Ý | + 3 |
| Houghton, R. et G. Woodwell, Pour la Science, 100 (juin 1996). | ||
Actuellement, les échanges de carbone entre le sol et l’air sont surtout le fait de processus naturels et de l’activité humaine. Le tableau 6.7 fait état de ces échanges. Les mêmes préoccupations doivent guider le choix des produits alternatifs à l’utilisation des fréons comme liquide caloporteur dans l’industrie du froid. Si le produit de substitution doit avoir un temps de vie atmosphérique le plus court possible pour ne pas atteindre les couches supérieures de l’atmosphère (Tableau 6.8), il doit aussi avoir un faible potentiel vis-à-vis l’effet de serre.
Tableau 6.8 Temps de vie t(ans)
des principaux fréons et halons
vis-à-vis l’effet de serre de fréons et de composés alternatifs
| M | CFC- | t(ans) | M | CFC- | t(ans) | M | CFC- | t(ans) |
| CCl3F | 11 | 45 | CF3Cl | 13 | 640 | CCl4 | 35 | |
| CCl2F2 | 12 | 100 | CHClF2 | 22 | 13,3 | CH3-CCl3 | 4,8 | |
| CCl2F-CClF3 | 13 | 85 | CHCl2-CF3 | 123 | 1,4 | CF3Br | 0,7 | |
| CClF2-CClF3 | 14 | 300 | CHClF-CF3 | 124 | 5,9 | |||
| CClF2-CF3 | 115 | 1700 | CH3-CCl2F | 141b | 9,4 | |||
| CH2F-CF3 | 134a | 14 | CH3-CClF2 | 142b | 19,5 | Halon | ||
| CHF2-CF3 | 125 | 36 | CHCl2-CF2-CF3 | 2225ca | 2,5 | CF2ClBr | 1211 | 11,0 |
| CH3-CF3 | 143a | 55 | CHClF-CF2-CClF2 | 225cb | 6,6 | CF3Br | 1301 | 65,0 |
| CH3-CHF2 | 152a | 1,5 | C2F4Br2 | 2402 | 6,0 | |||
| Tiré
de Volatile Organic Compounds in
the Atmosphere, Hester, R. E. et R. M. Harrison, édit., The Royal
Society of London, page 95, 1995 et de http://www.epa.gov/ozone/ods.html |
||||||||
__________________________________________
7. La photochimie sur les autres planètes
On divise les planètes en deux groupes : celui rassemblant les planètes où l’atmosphère est réductrice (les grosses planètes) et celui où l’atmosphère est oxydante (les petites planètes). On rattache le cas de la Terre à ce deuxième groupe.
Tableau 6.9. Composition (%) de l’atmosphère de Jupiter et de Saturne
| Molécules | Jupitera | Saturne |
| hydrogène | 76 | 94 |
| hélium | 24 | 6 |
| méthane | 0,175 | 0,45 |
| ammoniac | 0,018 | - - |
| éthane | 5 10-4 | 4,8 10-4 |
| acétylène | 2 10-6 | 1,1 10-5 |
|
a : Température et pression à la tropopause : -170 °C et 7 bars. |
||
L’atmosphère de ces planètes (Saturne, Jupiter, Uranus et Neptune) est majoritairement composée d’hydrogène : tableau 6.9. La photochimie est principalement le fait du méthane (l < 160 nm) et de l’ammoniac (160 < l < 230 nm), les deux seules molécules importantes en concentration avec des coefficients d’absorption convenables.
Le mécanisme réactionnel primaire sur Saturne est le suivant :
| Mécanisme primaire | Mécanisme secondaire | ||
| CH4 + h n | ® •CH3 + •H | :CH2 + H2 | ® •CH3 + •H |
| CH4 + h n | ® :CH2 + H2 | :CH2 + CH4 | ® 2 •CH3 |
| CH4 + h n | ® •CH + •H + H2 | •CH + CH4 | ® C2H4 + •H |
| •CH + H2 + M | ® •C2H3 + M | ||
| •CH3 + •H + M | ® CH4 + M | ||
|
2 •CH3 + M |
® C2H6 + M | ||
La sonde Cassini a passé plus de 20 années à sillonner l'extérieur de la planète Saturne. Elle a terminé sa course en se précipitant sur la planète. En traversant l'anneau intérieur D, elle a identifié des molécules de CH4, CO, N2, CO2, NH3 ainsi que de grosses molécules organiques. Ces molécules ne demeurent pas sur cet anneau : elles chutent vers la planète à très grandes vitesses. Elles réagissent avec des protons et des ions avant de toucher les couches supérieures de l'atmosphère de Saturne.
Sur Jupiter, à ces réactions, il faut ajouter les réactions suivantes (NH3 joue le rôle d’un photosensibilisateur dans la photodécomposition de l’hydrogène) :
NH3 + hn ® •NH2 + H•
•NH2 + H2 ® NH3 + H•
globalement : _________________________
H2 + hn ® 2 H•
ainsi que les réactions secondaires suivantes :
| •NH2 + •NH2 + M | ® N2H4 + M |
| N2H4 + hn | ® N2 + 2 H2 |
| •H + N2H4 | ® •N2H3 + H2 |
| •H + •N2H3 | ® N2 + 2 H2 |
| •NH2 + H2 | ® NH3 + H• |
| •NH2 + •CH3 | ® CH3NH2 |
| CH3NH2 + hn | ® produits |
Comme on peut le voir, la majorité de la photochimie de l’ammoniac sert à dissocier l’hydrogène moléculaire. À ces grosses planètes on ajoute le cas de Titan, un satellite de Saturne. L’atmosphère de ce satellite est surtout composée d’azote et de composés hydrocarbonés. La photochimie résultante provient de la photodécomposition du méthane (l < 160 nm) - voir ci-haut -, de l’éthane (160 < l < 230 nm) et de l’acétylène (180 < l < 220 nm).
Tableau 6.10. Composition de l’atmosphère de Titan
| Molécules | N2 | CH4 | H2 | C2H6 | C2H2 | C2H4 | CO | Ar | C3H8 |
| % | 97 | 2,1 | 0,2 | 0,002 | 3 10-4 | 4 10-5 | 6 10-4 | < 10-2 | 4 10-4 |
Réactions primaires (en plus de celles du méthane) :
| C2H6 + hn ® C2H4** + H2 | et |
C2H2 + hn ® •C2H + •H |
| C2H4** ® C2H2 + H2 | •C2H + CH4 ® C2H2 + •CH3 | |
globalement : |
CH4 + hn ® •CH3 + •H |
La photochimie de l’acétylène sert en grande partie à photodécomposer le méthane : c’est un bel exemple de photosensibilisation. À ces réactions, il faut ajouter les réactions secondaires d’addition des atomes d’hydrogène sur l’éthylène, ainsi que les réactions de combinaison des radicaux méthyles, éthyles, et •C2H. Cela explique en particulier les petites quantités de propane présentes dans l’atmosphère de Titan. Finalement, des chercheurs ont proposé, suite à leurs observations, que l’atmosphère de ce satellite montre un phénomène de nuages et de précipitations à base de méthane similaire à ce que l’on observe sur la terre avec l’eau. En confirmation, un lac principalement constitué d'éthane et de la grandeur du lac Ontario a été observé près du pôle Sud de Titan.
Récemment, des observations réalisées à l'aide de spectromètres de masse embarqués sur la sonde de la NASA, Cassini, ont montré des évidences de formation de benzène, de dérivés naphtaléniques et anthracéniques et de molécules encore plus complexes à des altitudes de l'ordre de 1000 km. Les mécanismes réactionnels mettraient en cause des ions et des molécules neutres un peu à limage de ce qui se passe dans la ionosphère terrestre.
Tableau 6.11. Physico-chimie des atmosphères de Vénus et de Mars
| Molécules (%) | Vénus | Mars |
| CO2 | 97 | 90 |
| N2 | 2 | 6,6 |
| Ar | 0 - 1,5 | |
| O2 | < 10-4 | 0,1 - 0,3 |
| CO | 0,005 | 0,09 |
| H2O | 0,5 - 1 | 0,004 - 0,002 |
| HCl | 6 10-5 | - - |
| T au sol (°C) | 474 ± 20 | -90 à -30 |
| P au sol (mbar) | 88 ± 15 103 | 7,5 |
b- Les planètes oxydantes (les petites planètes)
Les atmosphères de ces planètes (Mars, Vénus, Mercure) sont caractérisées par la présence de composés oxygénés : tableau 6.11. La photochimie est contrôlée par les deux réactions primaires suivantes :
CO2 +
hn ® CO + O•
H2O + hn ® H•
+ HO•
Les quatre réactions suivantes, globalement, oxydent le CO en CO2. Il faut enfin ajouter les réactions secondaires suivantes. Bien que différentes sur chacune des deux planètes, leur résultat net est encore l’oxydation de l’oxyde de carbone en gaz carbonique.
2 H• + 2 O2 ® 2 HO2•
HO2• + HO2• ® H2O2 + O2
H2O2 + hn ® 2 •OH
2 CO + 2 •OH ® 2 CO2 + 2 H•
globalement : ______________________________
2 CO + O2 + hn ® 2 CO2
Il faut enfin ajouter les réactions secondaires suivantes. Bien que différentes sur chacune des deux planètes, leur résultat net est encore l’oxydation de l’oxyde de carbone en gaz carbonique.
Sur Vénus : Sur Mars :
| CO + Cl• | ® ClCO• | CO + •OH | ® CO2 + H• |
| ClCO• + O2 | ® ClCO3 | •H + O2 | ® HO2• |
| ClCO3 + O• | ® Cl• + O2 + CO2 | HO2• + O | ® O2 + HO• |
ou globalement,
| CO + O• | ® CO2 | CO + O• | ® CO2 |
À ces planètes "oxydantes" on peut rattacher un cas un peu spécial : celui de Io, l’un des satellites de Jupiter. Son atmosphère est particulièrement originale puisqu’elle est principalement composée d’anhydride sulfureux provenant de sources volcaniques. La pression y est très faible! La gravité de cette lune est insuffisante pour retenir cette vapeur. La photochimie peut s’y schématiser ainsi :
SO2 + hn ® SO + O•
l < 221 nm
SO2 + hn ® S + O2
l < 207 nm
S + O2 ® SO + O•
SO + SO ® SO2 + S
au total : __________________________
SO2 + 2 hn ® S
+ 2 O•
c- La photochimie interstellaire
Plus d’une centaine de molécules (y inclus des ions et des radicaux) ont pu être identifiées par des moyens spectroscopiques. Parmi celles-ci on retrouve une trentaine d’entités diatomiques (H2, NO, OH, SO, CS, SH, CH+,…), triatomiques (C3, CH2, HCO, SiCN, AlNC, N2H+, …), une quinzaine d’individus comptant 4 atomes, 5 atomes,… On en retrouve plusieurs membres de la série HCxN où x = 5, 7, 9 et même 11 ! L’information sur ces molécules provient principalement des études faites en spectroscopie de rotation dans la région des microondes (voir le cours "Chimie théorique", Chapitre 3).
Bien que la chimie en phase gazeuse (en particulier les réactions de type ion-molécule, voir plus loin) est importante, les réactions sur la surface des particules ou sur la couche de glace qui les recouvre sont importantes. Ces particules solides sont de très petites dimension (de l’ordre du micromètre ou moins) et à ces températures sont constituées de toutes les espèces mentionnées plus haut… Les conditions expérimentales ne sont évidemment pas aisées à étudier au laboratoire.
__________________________________________________
|
1- Le mécanisme suivant a été proposé pour expliquer la décomposition thermique de l'ozone :
|
O3 |
® |
O2 + O• |
k1 |
|
O• + O2 |
® |
O3 |
k2 |
|
O• + O3 |
® |
2 O2 |
k3 |
À l'aide de l'hypothèse de l'état stationnaire, trouver une expression pour la vitesse d'évolution de l'oxygène d[O2]/dt.
2- La réaction suivante a donné lieu à de nombreuses études en phase gazeuse :
|
H2(g) + I2(g) |
® |
2 HI(g) |
Avant 1967, le mécanisme suivant était généralement accepté
|
H2(g) + I2(g) |
® |
2 HI(g) |
k |
En 1967, Sullivan a montré que la réaction se produit vraisemblablement par le mécanisme suivant :
|
I2 |
® |
2 I• |
k1 |
|
2 I• |
® |
I2 |
k2 |
|
2 I• + H2 |
® |
2 HI |
k3 |
a. Obtenir l'expression pour la vitesse de formation du HI d'après chacun des mécanismes en utilisant si nécessaire l'hypothèse de l'état stationnaire.
b. Obtenir l'expression pour la vitesse de formation du HI d'après le second mécanisme si les réactions (1) et (2) donnent lieu à l'équilibre suivant :
|
I2 |
® |
2 I• |
où la constante d'équilibre est K. Sous quelles conditions les expressions de vitesse trouvées en a) et en b) pour le second mécanisme seront-elles équivalentes ?
3- On admet qu’il y a une concentration de 7,2 1011 molécules·cm-3 d’ozone et 106 molécules·cm-3 de radicaux •OH dans la troposphère pendant le jour. Si les constantes de vitesse entre le D3-carène et ces deux réactifs sont, respectivement, de 1,2 10-16 et 8,7 10-11 cm3·molécule-1·s-1, calculez le pourcentage de consommation de ce terpène avec chacun de ces deux réactifs. Quel sera le temps de vie moyen d’une molécule du D3-carène? Mêmes questions pour la nuit si l’on admet qu’il y a en plus des radicaux NO3 en concentration de 2,4 108 molécules·cm-3 et que la constante de vitesse de la réaction avec le même terpène est de 1,1 10-11 cm3·molécule-1·s-1 ?
4- La constante de vitesse de la réaction •OH + CH4 a été mesurée par
de nombreux auteurs. Parmi ceux-ci, Greiner [J.
Chem. Phys., 53, 1070 (1970)] a
obtenu les résultats qui apparaissent dans le tableau suivant :
| T (K) | 295 | 301 | 333 | 370 | 424 | 492 | 498 |
| k (•OH + CH4)* | 0,085 | 0,080 | 0,154 | 0,352 | 0,611 | 1,21 | 1,22 |
|
* : 1011 cm3 · molécule-1 · s-1 |
|||||||
Calculez le facteur pré exponentiel et l’énergie d’activation de la réaction.
5- La réaction suivante a
été étudiée en suivant la concentration des radicaux hydroxyles par la
méthode de fluorescence en résonance [Chang et al., J. Chem. Phys.,
66, 4989 (1977)] :
•OH + CCl2=CCl2 ® produits
|
Température (K) |
297 |
341 |
341 |
350 |
378 |
403 |
420 |
|
1013 kexp(•OH + C2Cl4) |
1,69 |
2,70 |
2,76 |
3,03 |
4,24 |
4,77 |
5,26 |
Calculez le facteur pré-exponentiel et l’énergie d’activation de la réaction : k = cm3·molécule-1·s-1.
Le trichloroéthylène est utilisé dans l’industrie du nettoyage à sec et il réagit éventuellement dans l’atmosphère. Selon les mêmes auteurs, il réagit avec le radical •OH avec les constantes de vitesse apparaissant dans le tableau suivant. Calculez le facteur pré-exponentiel et l’énergie d’activation de la réaction : k = cm3·molécule-1·s-1.
| T (K) | 234 | 237 | 243 | 250 | 260 | 296 | 343 | 420 |
| 1012 kexp(•OH + C2HCl3) | 3,12 | 3,65 | 3,73 | 3,14 | 3,06 | 2,37 | 1,74 | 1,67 |
Que pensez-vous de cette énergie d’activation ? Proposez une explication pour ce comportement.
6- La constante de vitesse de la réaction
HOSO2 + O2 ® HO2 + SO3
a été mesurée à diverses températures* :
| T(K) | 297 | 320 | 334 | 383 | 423 |
| k (1013 cm3 · molécule-1 · s-1) | 4,37 | 4,68 | 5,09 | 5,61 | 6,09 |
* Gleasson, J. F. et C. J. Howard, J. Phys. Chem., 92, 3414-17 (1988).
Calculez l’énergie d’activation de cette réaction ainsi que le facteur pré exponentiel.
7- Le mode principal de génération d’énergie par le Soleil est le mécanisme nucléaire suivant :
[1] 2 H• + 2 H• ® 2 D• + 2 e+ + 2 g
[2] 2 D• + 2 H• ® 2 3He + 2 g
[3] 3He + 3He ® 4He + 2 H•
[4] 2 e- + 2 e+ ® 4 g
Dans ces équations e+, e-, n et g sont, respectivement, le positon, l'électron, le neutrino et le rayonnement gamma.1- Établissez la réaction globale ainsi que l’équation de vitesse.
2- Calculez les concentrations en atomes de deutérium, [•D], et en atomes d’hélium 3, [3He], en fonction de la concentration en atomes d’hydrogène, [•H] ainsi que des constantes de vitesse. On indique que l’étape limitante est la réaction [1].
8- Dans un mélange d’air contenant, en plus de l’azote (80 %), de l’oxygène (19 %) et de l’argon (1 %) sous une pression de 485 mm de Hg, on introduit du 1,2-butadiène (C4H6) et de l’isobutène (en quantités égales : 0,75 mm de Hg) susceptibles de réagir avec les atomes d’oxygène O·(3P) selon le mécanisme suivant :
[1] O• + O2 + N2 ® O3 + N2, k1 = 5,70 10-34 cm6 ·molécule-2· s-1
[2] O• + O2 + O2 ® O3 + O2, k2 = 5,96 10-34 cm6· molécule-2· s-1
[3] O• + O2 + Ar ® O3 + Ar, k3 = 3,81 10-34 cm6· molécule-2· s-1
[4] O• + 1,2-butadiène ® CO + C3H6, k4 = 5,921 10-12 cm3· molécule-1· s-1
[5] O• + isobutène ® produits, k5 = 17,35 10-12 cm3· molécule-1· s-1
Évaluer l'importance relative de chacune des réactions.
Pour en savoir beaucoup plus :
Wayne, R. P., Atmospheric Chemistry: the Evolution of our Atmosphere, J. Photochem., Photobiol. A: Chem., 62, 379-96 (1992);
Aimedieu, P., La querelle de
l’ozone, La Recherche, 106, 270-83 (1988);
Trous d’ozone polaire : de nouvelles questions, La Recherche, 205,
1518-22 (1988);
Duplessy,
J.-C. et G. Lambert, Le gaz carbonique: polluant majeur de l’atmosphère?, La Recherche, 174, 880-90 (1986); Divers auteurs,
L’effet de serre, Numéro spécial La Recherche, 243, mai
(1992).
Y. Sciama, Effet de serre : l'inquiétant effet cirrus des avions, Science
et Vie, 1052, 106-111 (mai 2005).
Un excellent résumé préparé par Godin-Beekmann, S., L'ozone stratosphérique - Rôles complexes du Soleil et des activités humaines dans son équilibre, L’Actualité chimique (Société française de chimie), 397-398, 86-90, juin-juillet 2015.
Irreversible effects - Climate change: sea-level rise, drying of some regions may continue for centuries... Chem. & Engin. News, 11, 2 février 2009.
Berner, R. A. et A. C. Lasaga, Modeling the Geological Carbon Cycle, Scientific American, 74-81, mars 1989.
Hileman, B., Global Warming, Chem. & Engin. News, 13 mars 1989, pages 25-44; Stark effects from gobal warming, 21 mars 2005, pages 47-48;
P. C. Zurer, Complexities of Ozone Loss Continue to Challenge Scientists, Chem. & Engin. News, 20, 12 juin 1995; Artic ozone layer may now have its own hole, Chem. & Engin. News, 60, 24 novembre 1997
.E. Wilson, Antartic ozone hole shows sign of repair, Chem. & Engin. News, 7, 4 juillet 2016.
Baum, R., Wintertime reflections on global warming, Chem. & Engin. News, 45, 25 janvier 1999.
Methane clouds bring "rain" to Titan, Chem. & Engin. News, 53, 23 octobre 2000.
R. Petkewich, Fertilizing the ocean with iron, Chem. & Engin. News, 30-33, 21 mars 2008.
Probing Titan's smog, J. Kemsley, Chem. & Engin. News, 11, 14 mai 2007.
Volatile Organic Compounds in the Atmosphere, Hester, R. E. et R. M. Harrison, édit., The Royal Society of London, 1995.
Un groupe de recherche international dirigé par David E. Oram a produit une quantité importante de travaux sur l'interaction entre des dérivés chlorés et/ou fluorés tels que les CH2Cl2, CH2ClCH2Cl, CFC-114, CFC-114a, ... et l'ozone. On trouvera plusieurs de ces travaux dans la revue Atmos. Chem. Phys., 16, 15347-15358, (2016); 17, 11929-11941 (2017); ...
Sur le même sujet: une étude cinétique de la chimie de l’isoprène en présence des radicaux hydroxyles. A. P. Teng, J. D. Crounse et P. O. Wennberg, Isoprene peroxy radical dynamics, J. Am. Chem. Soc., 139(15), 5367-5377 (2017).
Unexpected epoxide formation in the gas-phase photooxidationof isoprene, Fabien Paulot et al., Science, 325, 730-733 (7 août 2009);
Atmosperic hydroxyl radical production from electronically excited NO2 and H2O, S. Li, J. Matthews et A. Sinha, Science, 319, 1657-1660, 21 mars 2008.
Rawls, R. C., Interstellar chemistry, Chem. & Engin. News, 31-37, 15 juillet 2002.
Divers auteurs, L’atmosphère, Numéro spécial Pour la science, juin 1996.
Sur le cycle du mercure :
Picot, A. et N. Proust, Le mercure et ses composés, L’Actualité chimique (Société française de chimie), 4, 16-24, avril 1998.
Dalton, L. W. , Methylmercury toxicology probed, Seafood contaminant moves through the body, often posturing as benign molecule, Chem. & Eng. News, 70-71, 19 janvier 2004.
E. Wilson, Spacecraft finds liquid ethane in giant lake on Saturn's moon Titan, Chem. & Eng. News, 11, 4 août 2008.
Sur le NET:
On ne doit pas se priver de faire des recherches sur le Net tout en maintenant un regard critique sur la qualité des sites observés. Privilégier les sites gouvernementaux, universitaires, les grandes industries, les Fondations, ...
Les sites Web ne manquent pas. En voici quelques uns qui répondront probablement à plusieurs de vos questions et plus encore.Une discussion détaillée des réactions ioniques dans l’atmosphère terrestre présentée par Smith, D. et P. Panel, Mass Spectrometry Reviews, 14, 255-278 (1995)rstellaires : http://www.jh-inst.cas.cz/~spanel/interste.htm (2020-11-04)
. .Et le service de surveillance du ministère du commerce des États-Unis: https://www.esrl.noaa.gov/gmd/ccgg/trends/ (2020-11-04).
Un autre site polyglotte présente aussi des Regards sur le Système solaire, des animations, des images, … https://solarviews.com/eng/homepage.htm (2020-11-04)
.Les trouvailles de la sonde Cassini, Sam Lemonick, Chem. & Engin. News, page 7, (8 octobre 2018).
Le réseau de surveillance d'ozone - Environnement Canada est très riche de nombreuses données et d'informations diverses https://exp-studies.tor.ec.gc.ca/clf2/f/main.html (2020-11-04).
Une série d'articles consacrés à l'origine de la vie sur terre. On y traite de l'exploration spatiale, des interactions entre divers astéroïdes, dont les comètes, et la Terre. Voir et surtout lire: divers auteurs, L'Actualité chimique (Société chimique de France, No 455, pages 6-49 (octobre 2020).
Le site de la Fondation Nobel permet d’obtenir des informations sur quelques chercheurs mentionnés dans ce chapitre: CRUTZEN
, ROWLANDS,ARRHÉNIUS, ... Voir, par exemple, https://www.nobelprize.org/prizes/lists/all-nobel-prizes-in-chemistry/ (site visité le 2020-11-04).
Dernière révision: 20
21-07-02.xxxxxxxxxxxxxxxxxxxxx