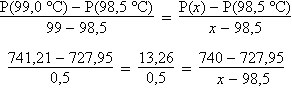
Chapitre 7
Problème Nº 1
CORRIGÉ
________________________________________
Problème Nº 2
CORRIGÉ
________________________________________
Problème Nº 3
Le mélange benzène toluène se comporte de manière idéale. À 30 °C la pression de vapeur du benzène pur est de 118,2 mmHg et celle du toluène pur est de 36,7 mmHg. Déterminez les pressions partielles et la composition en masse de la vapeur en équilibre avec un mélange liquide des deux composés 50:50 en masse. La masse molaire du benzène est de 78 g et celle du toluène de 92 g.
CORRIGÉ
Supposons un mélange liquide contenant 100 g de chacun des deux composés. Le nombre de moles de chacun des deux composés est égal à sa masse divisée par sa masse molaire, soit :
N(benzène) = 100 / 78 = 1,282 moles et N(toluène) = 100 / 92 = 1,087 moles.
Le nombre total de moles incluent dans le mélange liquide est donc de 1,282 + 1,087 = 2,369 moles. En termes de fraction molaire n, la composition de la phase liquide est donc :
n(benzène) = 1,282 / 2,369 = 0,541 et n(toluène) = 1,087 / 2,369 = 0,459
Puisque le mélange se comporte comme un mélange idéal, la pression de vapeur du benzène en équilibre avec la solution est obtenue en multipliant la pression de vapeur de ce composé fois sa fraction molaire et similairement aussi pour celle du toluène.
P(benzène) = 118,2 × 0,541 et P(toluène) = 36,7 × 0,459
P(benzène) = 63,95 mmHg et P(toluène) = 16,85 mmHg
pour une pression totale de 80,8 mmHg.
________________________________________
Problème Nº 4
Diagramme binaire isotherme
Les tensions de vapeur du monométhyléther de l’éthylène glycol (A) et du monoéthyléther de l’éthylène glycol (B) sont respectivement de 154,4 et de 102,2 mmHg à 80 °C. À partir de ces données, calculez la composition de la phase gazeuse en fonction de celle de la phase liquide à l’équilibre pour tout le domaine de concentration du mélange binaire des deux éthers. On supposera que le mélange obéit à la loi de Raoult. Représentez ces résultats sur un diagramme yA = f(xA) à 80 °C.
Note : on calculera les valeurs demandées pour les concentrations xA = 0,0, 0,1, 0,2, … 0,9 et 1,0. x et y sont les fractions molaires.
CORRIGÉ
Voir
le corrigé du problème N° 8
________________________________________
Problème Nº 5
Diagramme binaire isobare
À
partir des tensions de vapeur données du benzène et du toluène purs et en
supposant que ces deux substances forment un mélange parfait, construisez le
diagramme isobare (T, x, y) de distillation de ce système sous la
pression atmosphérique. À
l’aide de ce diagramme, déterminez la composition et la température de la
vapeur sur le quatrième plateau, le mélange liquide du premier plateau
contenant 40 % de son poids en benzène. Les
tensions de vapeur du benzène (liquide 1) et du toluène (liquide 2) sous la
sont les suivantes :
| T (°C) | P(1) (mmHg) | P(2) (mmHg) | T (°C) | P(1) (mmHg) | P(2) (mmHg) |
| 80,02 | 760 | 300 | 100 | 1344 | 559 |
| 84 | 852 | 333 | 104 | 1495 | 625 |
| 88 | 957 | 379 | 108 | 1659 | 704 |
| 92 | 1078 | 432 | 110,4 | 1798 | 760 |
| 96 | 1204 | 492 |
CORRIGÉ
________________________________________
Nº
6 Coefficient de BUNSEN
Quelle est en grammes la quantité d’hydrogène absorbée par 1000 g de benzène à la pression atmosphérique de 760 mmHg et à 20 ºC si le coefficient de BUNSEN de l’hydrogène dans le benzène est a = 0,066 à 20 ºC. La densité du benzène est de 876 kg/m3 à 20 ºC et sa tension de vapeur est de 56 mmHg toujours à la même température de 20 ºC.
CORRIGÉ
Le volume de benzène correspondant à 1000 g est tel que :
Volume = Masse / Masse volumique = 1000 g / 876 g/litre = 1,142 litres
Si l’hydrogène était sous la pression de 760 mmHg, la quantité absorbée par le benzène serait égale au produit du coefficient de BUNSEN par le volume de benzène, soit :
Quantité d’hydrogène absorbée = 0,066 × 1,142 = 0,075 34 litres
La masse correspondante est facile à calculée si on se rappelle qu’une mole d’hydrogène (22,413 litres) a une masse de 2,0 g :
Masse d’hydrogène absorbée : 2,0 g/mole × 0,075 34 litres / 22,413 litre/mole = 6,72 10-3 g
Il reste une dernière correction à appliquer. En effet, l’hydrogène en équilibre au-dessus de la solution n’est pas sous la pression atmosphérique. La pression partielle du benzène étant de 56 mmHg, la pression partielle de l’hydrogène est égale à 760 – 56, soit donc 704 mmHg. La quantité d’hydrogène absorbée étant proportionnelle à sa pression en équilibre avec la solution, on obtient :
Masse d’hydrogène absorbée = 6,72 10-3 g × 704 / 760 = 6,23 10-3 g
Masse d’hydrogène absorbée = 6,23 mg
La masse d’hydrogène absorbée dans 1000 g de benzène est donc de 6,23 mg.
________________________________________
Problème
Nº 7
CORRIGÉ
________________________________________
Problème
Nº 8 Entraînement à la vapeur d'eau
Lors de sa préparation, 60 g de quinoléine doivent être extraites du milieu réactionnel par de la vapeur d’eau. Estimez la température d’ébullition du mélange hétérogène eau – quinoléine, la pression dans le laboratoire est de 740 mmHg.
Calculez la quantité exprimée en grammes de vapeur d’eau nécessaire pour extraire 60 g de quinoléine. Les pressions de vapeur de l’eau et de la quinoléine en fonction de la température sont données dans le tableau qui suit.
| Température | Pression de vapeur (mmHg) | |
| (°C) | eau | quinoléine |
| 98,0 | 707,27 | 7,62 |
| 98,5 | 720,15 | 7,80 |
| 99,0 | 733,24 | 7,97 |
| 99,5 | 746,52 | 8,15 |
| 100,0 | 760,00 | 8,35 |
CORRIGÉ
Dans le cas de deux liquides non miscibles (insolubles l’un dans l’autre, la pression de vapeur en équilibre avec le mélange liquide est simplement égale à la somme des pressions de vapeur saturante de chacun des liquides : équation 7.8.
On peut reprendre le tableau en y ajoutant deux colonnes : une indiquant la pression totale en fonction de la température, l’autre donnant le pourcentage de quinoléine en phase vapeur.
| Température | Pression de vapeur (mmHg) | %
de quinoléine |
||
| (°C) | eau | quinoléine | totale | |
| 98,0 | 707,27 | 7,62 | 714,89 | 1,066 |
| 98,5 | 720,15 | 7,80 | 727,95 | 1,0715 |
| 99,0 | 733,24 | 7,97 | 741,21 | 1,0753 |
| 99,5 | 746,52 | 8,15 | 754,67 | 1,080 |
| 100,0 | 760,00 | 8,35 | 768,35 | 1,086 |
La pression barométrique étant de 740 mmHg, le mélange hétérogène bout à une température légèrement inférieure à 99,0 °C. Une interpolation linéaire permet d’obtenir une température d’ébullition plus précise. En admettant que la pression de vapeur varie linéairement sur une zone relativement limitée de température, on peut effectuer le calcul entre 98,5 et 99,0 °C.
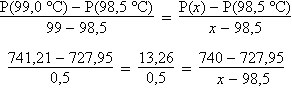
26,52
(x – 98,5) = 12,05
x
– 98,5 = 12,05 / 26,52 =
0,45
x = 98,95 °C
L’interpolation montre effectivement que ce que le tableau laissait entrevoir se confirme : la température d’ébullition est légèrement inférieure à 99,0 °C.
Une même interpolation en ce qui regarde le pourcentage de quinoléine dans la vapeur en équilibre avec le mélange montrerait que la quinoléine constitue 1,075 % du mélange de la vapeur. La quantité Q d’eau requise pour l’extraction de cette quinoléine peut être calculée :
0,010 75 = 60 / (60 + Q)
Q = 5 521 g d’eau.
________________________________________
Nº 9 Distillation de deux composés non miscibles
Un mélange d’eau et de 1,4-dichlorobenzène, deux liquides insolubles l’un dans l’autre, bout vers 96,5 ºC. On connaît les coefficients de l’équation d’ANTOINE (voir chapitre 4) pour chacun d’eux : tableau suivant.
| Composé | A | B | C |
| eau | 5,402 21 | 1838,675 | - 31,737 |
| 1,4-dichlorobenzène | 4,122 90 | 1575,110 | - 64,637 |
Déterminez :
a- La température d’ébullition du 1,4-dichlorobenzène.
b- La pression de vapeur saturante de chacun des deux constituants à 96,5 ºC.
c- La pression totale de la vapeur en cours de distillation.
CORRIGÉ
a- La relation d’ANTOINE donne la pression de vapeur saturante d’un constituant pur en fonction de sa température : chapitre 4, équation 4.20.
log10
P =
A -
[B / (T + C)]
La pression P est
exprimée en bar, T est en Kelvin et les coefficients A, B et C sont des valeurs
empiriques. La pression de vapeur
saturante au point d’ébullition normal est de 1 atmosphère que l’on
assimile à 1 bar. Le logarithme en
base 10 de 1 est nul. Par conséquent :
A
= [B
/ (T + C)]
et T
+ C =
B / A
T = B / A - C
En remplaçant par les valeurs numériques, on obtient :
![]()
T = 446,67 K
Et la température d’ébullition du 1,4-dichlorobenzène est telle que :
Téb = 173,5 ºC
b- La pression de vapeur saturante à 96,5 °C est obtenue en remplaçant à nouveau dans l’équation d’ANTOINE les valeurs littérales par leurs valeurs numériques. Ainsi, la pression de vapeur de l’eau est donnée par :
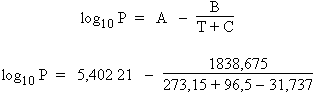
log10
P =
5,402 21 -
5,441 27 =
-
0,039 06
Pour obtenir la
pression P, il faut prendre l’exponentielle de l’équation précédente.
Il est nécessaire auparavant de transformer le logarithme décimal en
logarithme népérien :
Ln
P =
2,303 log10
P =
-
0,08995
et
P(eau) = 0,914 bar ou encore 685,5 mmHg
La même démarche avec la vapeur démarche se fait avec le 1,4-dichlorobenzène. On obtient :
P(1,4-dichlorobenzène) = 68,2 mmHg
c- La pression d’ébullition du système est évidemment égale à la somme des pressions de vapeur saturante de deux constituants, soit :
P(totale) = 685,5 + 68,2 = 753,7 mmHg.
Cette valeur est tout à fait compatible avec le fait que la pression atmosphérique normale à la température de 100 ºC est de 760 mmHg.
________________________________________