|
|
Les solutions diluées
|
Le chapitre précédent a montré que si un mélange de composés A et B peut constituer des solutions idéales sur toutes l’échelle de concentration, ce n’est certes pas la généralité. Dépendant de la présence ou non d’interactions entre les diverses molécules A et B, il peut exister des écarts importants, positifs ou négatifs par rapport à l’idéalité. Dans le cas général où on observe de tels écarts, dans le cas ou un soluté est suffisamment dilué, on observe que la solution se comporte comme une solution idéale. C’est l’objet spécifique de ce chapitre d’en établir les principales propriétés, propriétés appelées colligatives. Quelles sont les lois qui gouvernent les solutions diluées ?
|
1. Abaissement
de la tension de vapeur
La loi de RAOULT indique que la pression de vapeur en équilibre au-dessus d’une solution idéale est proportionnelle à la pression de vapeur saturante PAº du liquide pur à la même température multipliée par sa fraction molaire xA dans la solution (équation 7.4 et Fig. 8.1) :
8.1 PA = PAº × xA
|
|
Figure 8.1. Pression de vapeur d’un constituant au-dessus d’une solution idéale.
Comme d’autre part (B est le soluté),
xA = 1 – xB
Cela entraîne que :
8.2 PA = PAº × (1 – xB )
L’abaissement de la tension de vapeur du solvant A est tel que :
PAº –
PA = D PA =
PAº – PAº × (1 – xB )
= PAº
xB
| 8.3 |
D PA / PAº = xB |
L’abaissement relatif de la tension de vapeur du solvant dépend uniquement de la concentration du soluté.
2. Élévation
du point d’ébullition
On vient de montrer que l’ajout d’un soluté B en faible concentration dans un solvant A diminue la tension de vapeur du solvant. Graphiquement, dans un diagramme pression en fonction de la température, la courbe de la tension de vapeur est déplacée vers le bas (Fig. 8.2).
|
|
Figure 8.2. Déplacement de la courbe de la tension de vapeur sur ajout d’un soluté en faible concentration.
Il s’ensuit qu’à la pression atmosphérique P0, la température d’ébullition du solvant passe de T0 à T0 + DT. On observe effectivement une augmentation de la température d’ébullition du solvant. Ainsi l’eau salée bout à une température supérieure à celle de l’eau pure.
En première approximation et pourvu que la variation de la température soit petite, on peut assimiler les courbes donnant la pression en fonction de la température comme étant des portions de droites : la pression de vapeur saturante est proportionnelle à la température (Fig. 8.3) :
PAº = a T
|
|
Figure 8.3. Déplacement de la courbe de la tension de vapeur sur ajout d’un soluté en faible concentration.
Cette figure montre si besoin est que l’abaissement de la tension de vapeur, dans les présentes conditions, est indépendante de la température. De plus, l’exploitation de cette dernière figure permet d’établir les relations suivantes :
DPA' = PAº
- PA'
et DTA' = TA'
- TA
DPA"
= PAº
- PA"
et DTA"
= TA"
- TA
Ce qui entraîne que :
![]()
Ou encore,
DTA' = k' xB'
et DTA"
= k' xB"
D’une manière générale :
8.4 DTébull. = k xB
En détaillant quelque peu cette dernière formule, on obtient :
![]()
NA et NB sont les nombres de moles de A et de B présents dans la solution. Posons wA, wB, MA et MB, respectivement les masses et les masses molaires de A et de B, on obtient en remplaçant les nombres de moles par le rapport wA/MA et wB/MB :
![]()
Puisque la solution est diluée, la concentration de B est beaucoup plus petite que celle de A. Par conséquent, NA > NB .
| 8.5 |
|
Si on calcule
la variation de la température d’ébullition pour une mole de soluté dans
1000 g de solvant, on obtient (MA est exprimé en g/mol) :
| 8.6 |
|
Le
produit k MA / 1000 est appelé la constante ébullioscopique du
solvant kéb. Il
s’ensuit que :
8.7
DTébull.
= Constante ébullioscopique ´
wB / MB
Ainsi, quel que soit le soluté, peu importe le soluté, à concentration égale, l’augmentation de la température d’ébullition est la même. L’unité de cette constante peut être déduite de l’équation 8.6. La grandeur kéb s’exprime en degré par mole dans 1000 g de solvant, ou plus simplement en degré par molalité : [° · m-1]. Le tableau 8.1 donne des valeurs de la constante ébullioscopique de quelques solvants.
Tableau 8.1. Constante ébullioscopique de quelques solvants
|
Solvant |
Téb
du solvant (ºC) |
kéb observée | kéb calculée |
| Acétone | 56,5 | 1,72 | 1,73 |
| Alcool éthylique | 78,4 | 1,20 | 1,19 |
| Alcool méthylique | 64,7 | 0,80 | 0,83 |
| Benzène | 80,1 | 2,57 | 2,61 |
| Chloroforme | 61,2 | 3,88 | 3,85 |
| Eau | 100,0 | 0,52 | 0,51 |
| Éther diéthylique | 34,6 | 2,11 | 2,16 |
| Tétrachlorure de carbone | 76,8 | 5,0 | 5,02 |
| Tiré de Maron, S. H. et C. F. Prutton, Principles of Physical Chemistry, 4e édition, The MacMillan Co., New York, 1965. | |||
La constante ébullioscopique varie d’un solvant à un autre. On peut aussi remarquer que la même concentration dans le tétrachlorure de carbone et dans l’eau aura un effet presque 10 fois plus important dans le premier solvant.
Inversement, supposons que la constante kéb soit connue de même que DTébull. et wB. La mesure de l’augmentation du point d’ébullition d’une solution par addition d’une quantité connue de soluté permet de mesurer la masse moléculaire du soluté. C’est que l’on appelle l’ébulliométrie.
3. Abaissement
du point de congélation
À la température de fusion (ou de solidification), la tension de vapeur de la phase solide et celle de la phase liquides sont identiques. Par un raisonnement analogue au précédent, on montre l’ajout d’un soluté au liquide se traduit par un abaissement de la température de fusion :
|
DTA = TAº - TA = C xB = |
|
À
nouveau puisque la solution est diluée, NA
+ NB
» NA
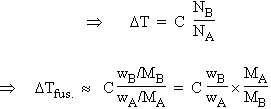
Comme généralement,
on mesure la quantité de soluté en grammes par 1000 g de solvant :
|
DTfus. = |
|
Pour un solvant particulier, posons C' = C × MA/ 1000. C' est appelé la constante cryoscopique du solvant.
8.8
DTfus.
= C' ´
wB / MB
Inversement, supposons que la constante C' soit connue de même que DTfus. et wB. La mesure de l’abaissement du point de congélation d’une solution par addition d’une quantité connue de soluté permet de mesurer la masse moléculaire du soluté. C’est que l’on appelle la cryométrie.
Ainsi, quel que soit le soluté, peu importe le soluté, à concentration égale, la diminution de la température de fusion est la même. L’unité de cette constante s’exprime encore en degré par mole dans 1000 g de solvant, ou plus simplement en degré par molalité : [° · m-1]. Le tableau 8.2 donne des valeurs de la constante cryoscopique de quelques solvants.
Tableau 8.2. Constante cryoscopique de quelques solvants
| Solvant |
Tfus du solvant (ºC) | Constante
C'
observée |
| Acide acétique | 16,7 | 3,9 |
| Benzène | 5,5 | 5,12 |
| Camphre | 178,4 | 37,7 |
| Cyclohexane | 6,5 | 20,0 |
| 1,4-dioxane | 10,5 | 4,9 |
| Eau | 0,0 | 1,86 |
| Naphthalène | 80,2 | 6,9 |
| Tribromophénol | 96 | 20,4 |
| Tiré de Maron, S. H. et C. F. Prutton, Principles of Physical Chemistry, 4e édition, The MacMillan Co., New York, 1965. | ||
La constante cryoscopique varie d’un solvant à un autre. On peut aussi remarquer que la même concentration dans le cyclohexane et dans l’acide acétique aura un effet près de 5 fois plus important dans le premier solvant.
4.
L’osmose
À partir de la thermodynamique (voir le cours de Thermodynamique chimique, Chapitre 9.5.c), on montre que la notion de pression dans un gaz peut s’appliquer à un soluté en solution. En fait, tout revient à imaginer que les molécules de solvant sont « absentes » du milieu. Il ne reste donc que les molécules de soluté qui se meuvent dans le volume de la solution comme un gaz dans une enceinte. On appelle ce type de pression la pression osmotique et les lois des gaz parfaits sont applicables, pourvu que l’on maintienne le système dans des conditions proches des conditions prévalant pour le gaz idéal.
Si n est le nombre de molécules dissoutes dans un volume V de solution, VAN’T HOFF a montré que la pression osmotique P est telle que :
| 8.9 |
P = a n / V |
Dans cette équation a est un coefficient de proportionnalité. En outre, ce coefficient a la même signification que la constante des gaz parfaits R, de telle manière que :
P
= R n / V
En fonction de la température, on a aussi la relation suivante :
8.10
P = R (n / V) T
Finalement, la loi de BOYLE – MARIOTTE est également valable pour la pression osmotique pourvu toujours que la solution soit diluée. Pour une solution plus concentrée, il faudrait faire appel à une loi semblable à celle de VAN DER WAALS (Chapitre 3.3).
8.11 P V = n R T
P
= R (n / V) T
![]()
| 8.12 |
P = R T C/ MB |
Le tableau 8.3 indique la pression osmotique de solution aqueuses de sucrose à diverses températures.
Tableau 8.3. Pression osmotique de quelques solutions aqueuses de sucrose à différentes concentration (fractions molaires) et températures
| n(sucrose) | 0 °C | 20
°C |
40 °C | 60 °C |
| 0,0018 | 2,46 | 2,59 | 2,66 | 2,72 |
| 0,0036 | 4,72 | 5,06 | 5,16 | 5,44 |
| 0,0054 | 9,44 | 10,14 | 10,60 | 10,87 |
| 0,0108 | 14,38 | 15,39 | 16,15 | 16,54 |
| 0,0144 | 19,48 | 20,91 | 21,80 | 22,53 |
| 0,0180 | 24,83 | 26,64 | 27,70 | 28,37 |
| Inspiré de Maron, S. H. et C. F. Prutton, Principles of Physical Chemistry, 4e édition, The MacMillan Co., New York, 1965. | ||||
Ainsi, la concentration saline du sang humain est voisine (ou équivalente) de 0,30 mol/litre. La pression osmotique du sang est donc (dans le système litre – atmosphère) :
P = R T (n / V) = 0,0820 × (273,15 + 37,5) × 0,30 = 7,64 atmosphères.
Cette propriété est importante et joue un rôle important dans le domaine des soins infirmiers. Imaginons qu’on injecte à un patient un médicament en solution. Si la solution a une pression osmotique très inférieure à celle du sang, les globules du sang en équilibre avec le sang, ayant donc une pression osmotique interne de 7,64 atmosphères sont en contacte avec un milieu dont la pression est très faible. Soumis à une différence pression importante dirigée de l’intérieur vers l’extérieur, ces globules vont tendre à se gonfler, voire à éclater, causant ainsi un traumatisme qui peut être dangereux. C’est le phénomène de la turgescence suivi de l’éventuel éclatement ou de l’hémolyse (Fig. 8.4).
|
|
Figure 8.4. Phénomènes sanguins : turgescence et plasmolyse.
On doit donc s’assurer avant l’injection que la solution est isotonique du sang, c’est-à-dire qu’elle a la même pression osmotique. Cette solution peut contenir du sucre ou éventuellement du sel pour satisfaire à cette exigence.
Inversement, si la pression osmotique de la solution est supérieure à celle du sang, donc à celle du liquide contenu dans les globules, la pression s’exerce de l’extérieur vers l’intérieur de la cellule. Celle-ci est maintenant écrasée par la pression externe : elle se recroqueville sur elle-même. C’est le phénomène de la plasmolyse.
4.b
Méthode de
mesure de la pression osmotique
Le principe de la mesure de la pression osmotique est basée sur l’utilisation d’une membrane semi-perméable. Celle-ci est perméable aux molécules de solvant et imperméables aux molécules de soluté. Cette membrane sépare deux compartiments (Fig.8.5) qui contiennent l’un le solvant pur (à gauche) et l’autre la solution (à droite).
|
|
Figure
8.5. Principe de la mesure de la
pression osmotique.
(Voir une courte animation, section Diaporama,
chapitre 8, diapos 21).
Supposons que les deux compartiments soient remplis et que les surplus de liquides montent à la même hauteur dans un tube latéral. Comme la pression osmotique est plus élevée dans le compartiment contenant la solution, les molécules de solvant du compartiment du solvant pur vont passer à travers la membrane semi-perméable pour abaisser la pression osmotique en diluant davantage la solution. Puisque le volume de la solution augmente, la solution monte dans le tube latéral.
Concurremment, le niveau dans le tube latéral du compartiment de gauche baisse. Lorsque la différence de niveau dans les deux tubes correspondant à une différence h de hauteur de niveau, égale à une différence de pression DP, est égale à la pression osmotique, on n’observe plus de montée du niveau dans le tube latéral du compartiment de droite : la pression hydrostatique contrebalance la pression osmotique. Si la masse volumique de la solution est égale à r, la pression osmotique est alors directement égale à :
P
=
DP
= h g r
g est évidemment la valeur de l’accélération de la pesanteur.
4.c Applications
Cette technique est particulièrement intéressante pour la mesure des masses moléculaires de polymères. Ces macromolécules sont par essence beaucoup plus grosses que les molécules de solvant. Il est donc relativement facile de synthétiser des membranes semi-perméables. Avec de plus petites molécules, des membranes animales présentes une semi-perméabilité qui les rende attrayante. Cette technique, l’osmométrie, est donc d’un usage très fréquent d’autant que la mesure d’une différence de niveau peut être relativement précise.
En 1945, McMILLAN et MAYER ont montré que, pour des composés non électrolytiques, l’expression de la pression osmotique pouvait aussi s’écrire sous la forme d’une équation similaire à celle du viriel :
| 8.13 |
|
Dans cette équation, Mn surmonté d’un trait horizontal indique la valeur moyenne de la masse moléculaire. B est second coefficient du viriel ; D en est le 3e, … Cette notion est importante lorsque le soluté est un polymère. En solution diluée, en ne retenant que les deux premiers termes, on obtient :
| 8.14 |
|
La figure 8.6 montre les résultats obtenus avec les poly pyrrolidones en solution dans l’eau.
|
|
Figure 8.6. Rapport pression osmotique sur la concentration en fonction de la concentration dans le cas des poly pyrrolidones dans l’eau.
L’extrapolation à concentration nulle ou l’interception des droites expérimentales avec l’axe de y donne la valeur du rapport RT/Mn. On a donc accès à la masse molaire moyenne du polymère :
| 8.15 |
|
Cette masse
moyenne s’appelle en fait la masse molaire moyenne
en nombre.
| 8.16 |
|
Dans cette équation, Mi est la masse molaire des ni particules.
Un autre exemple qui montre bien l’intérêt de l’osmométrie pour la mesure des masses molaires de polymères apparaît à la figure 8.7. Deux solvants différents montrent que l’extrapolation des données expérimentales du rapport pression osmotique sur la concentration est la même dans les deux cas même si les courbes expérimentales sont très différentes. Cette différence tient principalement à la plus grande solubilité du polyisobutène dans le cyclohexane comparativement à celle dans le benzène.
|
|
Figure
8.7. Rapport pression osmotique sur
la concentration en fonction de la concentration dans le cas d’un polyisobutène
en solution dans le benzène ou dans le cyclohexane.
Inspiré de Barrow, G. M., Physical
chemistry, 3e edition, McGraw-Hill Book Company, New York, 1973.
Supposons que les compartiment de droite de la figure 8.5 contienne de l'eau de mer, donc une eau très salée. La pression osmotique y sera de quelque 29 bars. Si l'on applique une pression hydrostatique égale ou même supérieure à cette pression, l'eau va refouler vers le compartiment de gauche. On a ainsi le principe du dessalement de l'eau de mer. Ce principe est applicable dans diverses industries dont celle de production du sirop d'érable. Il est en effet moins coûteux d'enrichir l'eau d'érable en utilisant ce principe qu'en utilisant le mode traditionnel du chauffage.
5. Les
solutions électrolytiques
Puisque la constante cryoscopique de l’eau est de 1,86 °/mol, l’abaissement du point de congélation de l’eau pour n’importe quel soluté devrait être identique. Une solution d’acide chlorhydrique montre plutôt que l’abaissement de la température de fusion est plutôt le double de celle prévue, soit 3,7 °C. Puisque l’abaissement de la température de fusion est directement proportionnel à la concentration du soluté, le rapport DTfus/m devrait être constant et égal à 1,86 °C/mol. À l’évidence, à haute concentration, la solution ne satisfait pas à cette condition. La solution est loin de l’idéalité. À faibles concentrations (ou à grandes dilutions), la valeur du rapport tend vers une valeur constante voisine de 3,7, soit le double de la valeur prévue théoriquement.
Une analyse plus systématique de différents électrolytes (Tableau 8.4) montre que l’abaissement cryométrique est proportionnel aux nombre d’ions libérés par la dissociation. Ainsi, les solutions diluées d’acide nitrique et de chlorure d’ammonium ont des comportements très semblables, les solutions d’acide sulfurique et de chlorure de cobalt montrent un abaissement cryométrique triple de la valeur théorique. On observerait la même limite pour le sulfate de potassium. La solution de HCl est en fait une solution d’ions H+ et d’ions Cl-, … On peut dire qu’il y a deux solutés et non un seul.
Tableau 8.4. Variations du rapport DTfus/m pour l’eau en fonction de la concentration (moles/litre) du soluté
| m |
HCl |
HNO3 |
NH4Cl | H2SO4 | CoCl2 |
K3Fe(CN)6 |
| 0,0005 | 7,3 | |||||
| 0,0010 | 3,690 | 7,10 |
||||
| 0,0020 | 3,669 | 5,35 |
6,87 |
|||
| 0,0050 |
3,635 |
3,67 | 2,871 | 4,814 |
5,208 |
6,53 |
| 0,0100 |
3,601 |
3,64 | 3,582 | 4,684 |
5,107 | 6,26 |
| 0,050 |
3,532 | 3,55 | 3,489 | 4,112 |
4,918 |
5,60 |
| 0,100 | 3,523 |
3,51 |
3,442 | 3,940 | 4,882 |
5,30 |
| 0,200 | 3,54 |
3,47 |
3,392 | 3,790 | 4,946 |
5,0 |
| 1,00 | 3,94 | 3,58 | 3,33 |
4,04 |
6,31 | |
| 4,00 | 5,65 |
4,16 | 3,35 |
7,05 | ||
| Tiré de Maron, S. H. et C. F. Prutton, Principles of Physical Chemistry, 4e édition, The MacMillan Co., New York, 1965. | ||||||
Ainsi, dans le cas d’un électrolytes, la concentration du soluté doit être comprise comme la concentration des espèces réellement présentes dans la solution.
Un intérêt du tableau précédent est qu’il montre bien la limite de ce que l’on peut appeler une solution idéale. Plus précisément, pour un soluté donné,, il établit les concentrations maximum au delà des quelles on ne peux plus considérer la solution idéale. Avec les ions tels que ceux suggérés dans le tableau, une solution de molalité supérieure à 0,002 s’écarte rapidement de l’idéalité.
6. Conclusions
Lorsque les solutions sont suffisamment diluées, elles se comportent comme des solutions idéales. Les lois de RAOULT s’appliquent à plusieurs de leurs propriétés. Il intéressant de noter que les propriétés de viscosité montrent que le composé dilué se comporte comme s’il se trouvait seul en phase gazeuse. Les lois similaires à celles des gaz parfaits à grande dilution ou des gaz non idéaux s’y appliquent. Ces lois
permettent de déterminer les masses moléculaires des composés dilués (solutés).
C’est une propriété intéressante comme par exemple dans le cas des
polymères.
|
Maron,
S. H. et C. F. Prutton, Principles of Physical Chemistry, 4e
édition, The MacMillan Co., New York, 1965.
Barrow,
G. M., Physical chemistry, 3ème edition, McGraw-Hill Book Company, New
York, 1973.
Moore,
W. J., Basic physical chemistry, Prentice-Hall, inc., Englewood Cliffs,
New Jersey, 1983.
Le Handbook of Chemistry and Physics, CRC Press, contient une grande variété et quantité d’informations très utile au chimiste. Ainsi, on trouve dans la 70e édition, 1989-1990, les tables suivantes :
| Nom de la table | Description sommaire | pages |
| Élévation de la température d’ébullition | Valeurs pour 20 liquides | D-188 |
| Abaissement de la température de fusion | Valeurs pour 14 liquides | D-188 |
Sur le Web :
Des propriétés physiques sont disponibles à plusieurs endroits sur le web. La solubilité exprimée en nombre de moles d’un soluté dans l’eau sous la pression de 1 bar (750 mmHg) pour un grand nombre de solutés à 298,15 °C se trouve à l’adresse suivante :
http://sis.nlm.nih.gov/chemical.html . (visité le 2019-02-12)
Un site en provenance d’Angleterre (université d’Oxford ?) où l’on traite de la pression osmotique en donnant l’exemple du néoprène dans le toluène :
http://physchem.ox.ac.uk/~rkt/lectures/osmotic.html (visité le 2019-02-12)
Un site en provenance de l’université de Montréal où l’on traite des solutions, des lois de Raoult et de Henry :
http://www.esi.umontreal.ca/~badiaa/CHM1995/Solutions-2.pdf (visité le 2019-02-12)
Et une liste biographies en français : Bunsen .
Problème Nº 1
Calculez la pression de vapeur à 25 ºC d’une solution qui contient 0,400 mole de sucre dans 500 g d’eau. On indique que la pression de vapeur saturante de l’eau à 25 ºC = 23,5 mmHg.
Réponse : Pression de vapeur de la solution = 23,2 mmHg
________________________
Problème Nº 2
Trouvez le point de congélation d’une solution qui contient 0,20 mole d’un soluté non dissocié dans 1 200 g de benzène. Le point de congélation du benzène est de 5,5 ºC.
Réponse : Tf (solution) = 4,65 ºC.
________________________
Problème Nº 3 La cryoscopie
A- Trouvez l’abaissement du point de congélation d’une solution contenant 1 g de polymère de masse moléculaire égale à 40 000 dans 100 g de benzène.
B- Calculez la pression osmotique de la même solution.
Réponse
: P
=
0,005 atm =
3,8 mmHg
C- Faire la comparaison entre la cryométrie et l’osmose au sujets des résultats précédents. Commentez.
________________________
Problème Nº 4
Une solution contient 7,2 g d’un soluté non volatil et non dissociable dans 250 g d’eau. Elle bout à 100,26 °C. Calculez le poids moléculaire du soluté.
Réponse
: Masse
molaire du soluté =
58 g mol-1
________________________
Problème Nº 5 Constante cryoscopique
Pour déterminer la constante cryoscopique de l’eau on mesure l’abaissement de la température de fusion de la glace contaminée par un soluté non dissociable dont la molalité m apparaît dans le tableau qui suit.
| m (molalité du soluté) | DTfus | m (molalité du soluté) | DTfus |
| 0,000 538 | 0,001 00 | 0,018 87 | 0,0350 |
| 0,004 235 | 0,007 85 | 0,030 84 | 0,0570 |
| 0,007 645 | 0,014 13 | 0,042 48 | 0,0785 |
| 0,012 918 | 0,0240 |
Calculez pour chacune des mesures la constante cryoscopique kfus. Indiquez la précision sur cette mesure.
________________________
Problème Nº 6 Masse moléculaire et tension de vapeur
La
tension de vapeur du tétrachlorure de carbone est de 85,513 mmHg à 19 °C.
La tension de vapeur d’une solution d’un produit 0,5455 g de
substance inconnue dans 25 g de tétrachlorure de carbone est de 83,923 mmHg
à la même température. Calculez
la masse moléculaire de cette substance inconnue et déterminez sa formule
empirique sachant que les résultats de l’analyse élémentaire montrent que
ce produit contient 94,34 % de carbone et 5,66 % d’hydrogène.
Réponse : C14H10.
________________________
Problème Nº 7 L'ébullioscopie
La dissolution de 1,6 g d'urée (masse molaire : 60,1 g) dans 120 g de solvant produit une solution dont le point d'ébullition est de 0,12 ° supérieur à celui du solvant pur. Calculez la constante ébullioscopie de ce solvant.
Réponse : keb = 0,54 ° · m-1
________________________
Problème Nº 8 Masse d'un polymère
On dissout un polymère inconnu dans du tétrachlorure de carbone de densité d = 1 594 k/m3. On observe à 20 °C les mesures de pression osmotique sont rapportées dans le tableau ci-inclus.
| C (g/cm3) | 0,02 00 | 0,004 00 | 0,006 00 | 0,008 00 |
| P (cm de CCl4) | 0,40 | 1,00 | 1,80 | 2,80 |
Quelle est la masse molaire du polymère ?
Réponse : Mn = 1,039 105 g/mol
________________________
Problème Nº 9 Masse molaire du soufre
Une solution de 3,75 g de soufre dans 100 g de bisulfure de carbone, CS2, bout à 46,66 °C. Quelle est la formule moléculaire du soufre dans cette solution ? On indique que le CS2 pur bout à 46,30 °C et que sa constante ébullioscopique de ce solvant est égale à 2,50 ° · m-1.
________________________
Problème Nº 10 Masse molaire et pression osmotique
1,553 g de chymotrypsinogène dissout dans 100 ml crée une pression osmotique de 157,0 mm d'une colonne d'eau (25 °C). Quelle est la masse molaire moyenne de la substance ?
________________________
Problème Nº 11 Pression de vapeur et solution
Calculez la pression de vapeur du benzène à 80,2 °C au-dessus d'une solution contenant exactement 0,2 mole d'une substance dissoute dans 250 g de benzène. La pression de vapeur du benzène est de 101 000 Pa à 80,2 °C.
________________________
Problème Nº 12 Sucre et abaissement cryoscopique
Une solution contenant 0,02 mole d'un sucre (M = 342 g/mol) dans 200 g d’eau. Calculez l'abaissement du point de congélation : la constante cryoscopique de l'eau est de 1,86 °C/mol. Évaluez l'incertitude absolue sur cette mesure.
Dernière mise à jour : 2019-02-12.
x x x x x x x x x x x x x